Jak cytować: Ściubisz M., Mrukowicz J.: Nietypowe zdarzenia zakrzepowe po szczepionkach przeciwko COVID-19. Stan wiedzy na 26 kwietnia 2021 roku. Med. Prakt., 2021; 5: 127–136
Skróty: CDC – Centers for Disease Control and Prevention, COVID-19 (coronavirus disease) – choroba spowodowana przez SARS-CoV-2, CVST (cerebral venous sinus thrombosis) – zakrzepica zatok żylnych mózgu, EMA (European Medicines Agency) – Europejska Agencja Leków, FDA (Food and Drug Administration) – Urząd ds. Żywności i Leków, HIT (heparin-induced thrombocytopenia) – małopłytkowość indukowana heparyną, NOP – niepożądany odczyn poszczepienny, PRAC (Pharmacovigilance Risk Assessment Committee) – Komitet ds. Bezpieczeństwa Farmakoterapii i Oceny Ryzyka, SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) – koronawirus zespołu ostrej niewydolności oddechowej 2, SVT (splanchnic veins thrombosis) – zakrzepica żył trzewnych, UE – Unia Europejska, VAERS – Vaccine Adverse Event Reporting System, VITT (vaccine-induced thrombotic immune thrombocytopenia) – indukowana szczepieniem zakrzepowa małopłytkowość immunologiczna, WHO (World Health Organization) - Światowa Organizacja Zdrowia
Pytanie 1. Czy szczepienie przeciwko COVID-19 preparatem wektorowym Vaxzevria (AstraZeneca) zwiększa ryzyko zdarzeń zakrzepowo-zatorowych?
Dostępne aktualnie dane wskazują, że istnieje prawdopodobny związek między szczepieniem preparatem Vaxzevria a występowaniem bardzo rzadkich, nietypowych zdarzeń zakrzepowych związanych z małopłytkowością (p. dalej), choć na razie nie potwierdzono jednoznacznie, że ma on charakter przyczynowy.1
W ramach rutynowego nadzoru nad bezpieczeństwem szczepień prowadzonego po wprowadzeniu preparatu Vaxzevria do powszechnego stosowania w Unii Europejskiej (UE) w kilku krajach zgłoszono przypadki zdarzeń zakrzepowo-zatorowych, w tym nietypowych, przebiegających z małopłytkowością, które wystąpiły w związku czasowym ze szczepieniem tym preparatem. Komitet ds. Bezpieczeństwa Farmakoterapii i Oceny Ryzyka (PRAC) działający przy Europejskiej Agencji Leków (EMA) sukcesywnie dokładnie analizował wszystkie przypadki tych zdarzeń zgłaszane do systemów nadzoru nad niepożądanymi odczynami poszczepiennymi (NOP) w poszczególnych krajach UE stosujących szczepionkę Vaxzevria (a także w Wielkiej Brytanii) oraz te, które zaobserwowano w przedrejestracyjnych badaniach z randomizacją (RCT) oceniających skuteczność i bezpieczeństwo preparatu.2-5 W stanowisku opublikowanym 7 kwietnia br. PRAC wskazał, że zgłoszone w ramach rutynowego nadzoru nad NOP nietypowe zdarzenia zakrzepowe przebiegające z małopłytkowością (rzadziej również z krwawieniem) dotyczyły głównie naczyń mózgu (zakrzepica zatok żylnych mózgua [CVST]), jamy brzusznej (zakrzepica żył trzewnychb [SVT]) i tętnic.6 Do 22 marca br., a zatem po zaszczepieniu preparatem Vaxzevria, około 25 milionów osób w krajach UE i Wielkiej Brytanii, do europejskiej Polbazy Eudra Vigilance zgłoszono 62 przypadki CVST i 24 przypadki SVT (w tym 18 zakończonych zgonem). Po analizie PRAC wyciągnął wniosek, że istnieje prawdopodobny związek między szczepieniem preparatem Vaxzevria a występowaniem bardzo rzadkich, nietypowych zdarzeń zakrzepowych przebiegających z małopłytkowością i należy je uwzględnić jako bardzo rzadki NOP, ale jednocześnie zaznaczył, że korzyści ze szczepienia preparatem Vaxzevria nadal przeważają nad potencjalnym ryzykiem z nim związanym, choć wielkość korzyści netto zmienia się zależnie od prawdopodobieństwa zakażenia SARS-CoV-2 (tzn. aktualnej zapadalności na COVID-19) oraz grupy wiekowej, a także innych czynników ryzyka (p. także s. 80 – przyp. red.).6,7
a Ten termin jest wiernym tłumaczeniem angielskiego akronimu CVST, ale właściwą nazwą jest zakrzepica zatok opony twardej.
b Zakrzepica dotyczy żyły wrotnej i/lub jej dopływów (tj. żyły śledzionowej i żył krezkowych) lub żył wątrobowych (zespół Budda i Chiariego).
EMA wskazała, że jednym z możliwych patomechanizmów tych nietypowych zdarzeń zakrzepowych może być odpowiedź immunologiczna prowadząca do podobnych zaburzeń i objawów, które obserwuje się u niektórych pacjentów leczonych heparyną – tzw. małopłytkowości indukowanej heparyną (HIT).1,6 Tę szczególną postać zdarzeń zakrzepowych po szczepieniu określono w piśmiennictwie angielskim jako vaccine-induced prothrombotic immune trombocytopenia (indukowana szczepieniem prozakrzepowa małopłytkowość immunologiczna – VIPIT) lub – aktualnie częściej – jako vaccine-induced immune thrombotic thrombocytopenia (indukowana szczepieniem zakrzepowa małopłytkowość immunologiczna – VITT). Za proponowanym przez EMA patomechanizmem przemawiają również wyniki opublikowanych niedawno opisów serii przypadków VITT zgłoszonych w Niemczech i Austrii (we wszystkich próbkach surowicy pobranej od 28 pacjentów z podejrzeniem VITT po szczepieniu preparatem Vaxzevria wykryto przeciwciała przeciwko kompleksom heparyna–płytkowy czynnik 4 [PF4] i uzyskano dodatni wynik diagnostycznego testu czynnościowego, mimo że żaden pacjent nie otrzymał wcześniej heparyny),8 a także Wielkiej Brytanii (w 22 z 23 przypadków VITT stwierdzono anty-PF4).9 Większość zgłoszonych do tej pory przypadków dotyczyła kobiet w wieku <60 lat i wystąpiła w ciągu 14 dni po podaniu pierwszej dawki szczepionki (zakres do 24 dni).
EMA zaleciła, aby personel medyczny zwracał
szczególną uwagę na objawy podmiotowe i przedmiotowe
nasuwające podejrzenie epizodu zakrzepowego
lub małopłytkowości u osób zaszczepionych
preparatem Vaxzevria, tak aby móc szybko
wdrożyć odpowiednie i skuteczne leczenie. Osoby
szczepione należy poinformować, aby zgłosiły się
do lekarza natychmiast, gdy tylko zauważą u siebie następujące objawy:
1) duszność
2) ból w klatce piersiowej, uporczywy ból brzucha,
silny i uporczywy ból głowy
3) obrzęk kończyn dolnych
4) niewyraźne widzenie
5) podbiegnięcia krwawe lub wybroczyny pojawiające
się kilka dni po szczepieniu i poza miejscem
wstrzyknięcia.
Zgodnie z obowiązującą rutynową procedurą EMA zaktualizowała charakterystykę produktu leczniczego (ChPL) preparatu Vaxzevria i uzupełniła ulotkę dla pacjenta o informacje o zarejestrowanych przypadkach zdarzeń zakrzepowych.10 Podsumowując wyniki swojej analizy, PRAC jednoznacznie stwierdził, że – biorąc pod uwagę powszechne zagrożenie związane z pandemią COVID-19 (w tym duże ryzyko hospitalizacji, leczenia na oddziałach intensywnej terapii oraz zgonu) i skuteczność szczepionki w zapobieganiu ciężkim zachorowaniom na COVID-19 oraz bardzo małą częstość zdarzeń zakrzepowych z małopłytkowością po szczepieniu (wg najnowszych oszacowań 1 przypadek / 100 000 dawek) – korzyści wynikające ze szczepienia preparatem Vaxzevria nadal przewyższają potencjalne ryzyko z nim związane we wszystkich grupach wiekowych.6,7
Po przeanalizowaniu danych z nadzoru
we wszystkich krajach stosujących szczepionkę
Vaxzevria – po podaniu łącznie prawie 200 milionów
dawek preparatu – takie samo stanowisko
wydała Światowa Organizacja Zdrowia
(WHO).11 EMA i WHO zapewniły, że nadal będą
ściśle monitorować wszystkie przypadki zdarzeń
zakrzepowo-zatorowych zgłoszone po podaniu zarówno
preparatu Vaxzevria, jak i innych dostępnych
szczepionek przeciwko COVID-19.6,11 W podobnym do EMA i WHO duchu wypowiedzieli
się eksperci Grupy ds. Hemostazy Polskiego Towarzystwa Hematologów i Transfuzjologów,
ale dodatkowo – na podstawie dostępnych
przed 13 kwietnia br. zaleceń niemieckich,
brytyjskich i kanadyjskich – zaproponowali modyfikację
kwalifikacji do szczepienia preparatem
Vaxzevria i postępowania w przypadku podejrzenia
VITT (p. ramka), sugerując użycie innej szczepionki u osób z HIT lub zakrzepicą zatok żylnych
mózgu w wywiadzie (pytanie o te zdarzenia zostało
już oficjalnie wprowadzone do nowej wersji
Komikwestionariusza kwalifikacyjnego do szczepienia
przeciwko COVID-19).12 Z kolei British Society
for Haematology zaproponowało algorytm postępowania
diagnostycznego i leczenia w przypadku
podejrzenia VITT (ryc. 1).9,13
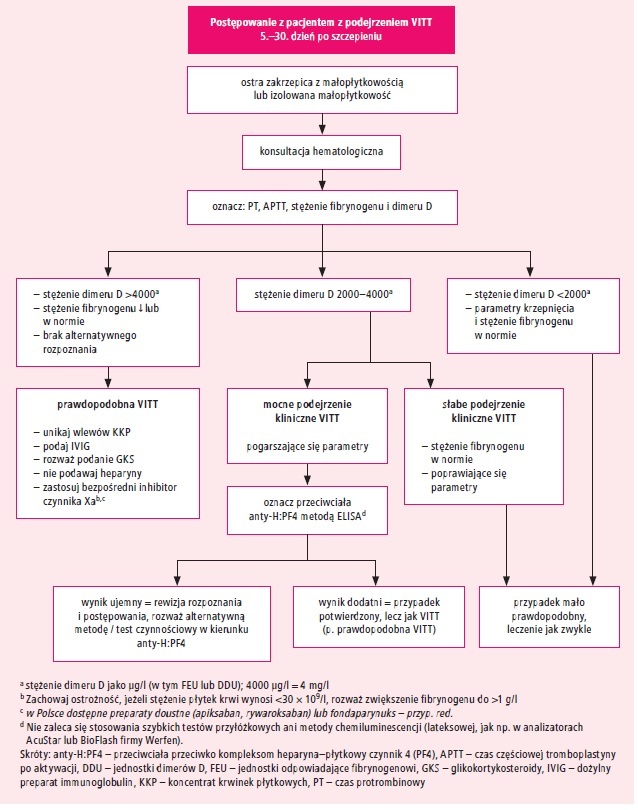
Ryc. 1. Postępowanie w przypadku podejrzenia
indukowanej szczepieniem zakrzepowej małopłytkowości immunologicznej (VITT)
wg wytycznych British Society for Haematology (na podstawie 13. pozycji
piśmiennictwa)
Uaktualnione stanowisko ekspertów ds. hemostazy Polskiego Towarzystwa Hematologów i Transfuzjologów w sprawie szczepionki przeciwko COVID-19 firmy AstraZeneca (13.04.2021 r.), uzgodnione z Naczelną Radą Lekarską
Opracowali: prof. dr hab. n. med. Anetta Undas, prof. dr hab. n. med. Maria Podolak-Dawidziak (Przewodnicząca Sekcji), prof. dr hab. n. med. Piotr Pruszczyk, prof. dr hab. n. med. Jerzy Windyga w imieniu grupy ds. hemostazy Polskiego Towarzystwa Hematologów i Transfuzjologów
W świetle aktualnych danych szczepienie przeciwko zakażeniu wirusem SARS-CoV-2
preparatem firmy AstraZeneca (Vaxzevria – przyp. red.)
jest skuteczne w zapobieganiu ciężkim postaciom COVID-19.
Ryzyko wystąpienia incydentów zakrzepowo-zatorowych jest małe, podobne jak w populacji ogólnej. Odnotowano jednak bardzo rzadką, szczególną postać incydentów zakrzepowych po podaniu szczepionki firmy Astra-
Zeneca (częstość 1–10 przypadków / mln zaszczepionych; dotąd w Europie zgłoszono <200 przypadków), określaną angielskim akronimem
VITT (vaccine-induced thrombotic thrombocytopenia), zwaną też VIPIT (12). Powikłanie to najczęściej obserwuje się po upływie 4–20 dni
od podania szczepionki firmy AstraZeneca, zwykle u osób <55. rż., częściej u kobiet niż u mężczyzn. Objawy choroby przypominają nabytą
trombofilię na podłożu autoimmunologicznym, tj. małopłytkowość indukowaną heparyną (heparin-induced thrombocytopenia – HIT), mimo
że chory nie otrzymywał heparyny w ostatnich dniach. Typową zmianą jest zmniejszenie liczby płytek we krwi obwodowej <150 000/µl (bez
zwiększenia ryzyka krwawienia). Manifestacje kliniczne VITT to przede wszystkim zakrzepica zatok żylnych mózgowia, ale także zakrzepica
żył trzewnych, zakrzepica żył głębokich o innym umiejscowieniu, a także udar niedokrwienny mózgu lub zatorowość obwodowa.
Na podstawie dostępnych do 13 kwietnia 2021 r. zaleceń ekspertów (w tym niemieckich, brytyjskich i kanadyjskich) proponujemy
następujące postępowanie:
1. Odradzamy szczepienie przeciwko zakażeniu wirusem SARS-CoV-2
szczepionką firmy AstraZeneca pacjentów, którzy w przeszłości przebyli
udokumentowaną lub prawdopodobną HIT.
2. Odradzamy szczepienie przeciwko zakażeniu wirusem SARS-CoV-2
szczepionką firmy AstraZeneca pacjentów, którzy w przeszłości przebyli
zakrzepicę zatok żylnych mózgu.
3. Sugerujemy baczną obserwację przez 20 dni po podaniu szczepionki firmy AstraZeneca pacjentów po przebyciu żylnej choroby zakrzepowo-zatorowej
lub obciążonych zwiększonym ryzykiem zakrzepowo-zatorowym, którzy nie otrzymują leków przeciwkrzepliwych, osób z nadwagą i otyłością.
4. Zalecamy pilny kontakt z lekarzem, jeśli między 4. a 20. dniem po szczepieniu szczepionką AstraZeneca pacjent zgłasza przynajmniej
jeden z następujących objawów: silny uporczywy ból głowy, zaburzenia widzenia, drgawki, ogniskowe objawy neurologiczne, duszność,
ból w klatce piersiowej lub w jamie brzusznej, obrzęk lub niesymetryczny ból kończyny dolnej.
5. Zalecamy u pacjentów z podejrzeniem VITT ocenę morfologii krwi z rozmazem (aby wykluczyć lub potwierdzić małopłytkowość) oraz
stężenia dimeru D, a także wykonanie badań obrazowych, aby potwierdzić lub wykluczyć zakrzepicę.
6. Chorych z podejrzeniem VITT powinno się hospitalizować.
7. U chorych hospitalizowanych wskazana jest konsultacja hematologiczna (osobista lub telefoniczna) i oznaczenie przeciwciał przeciwko
kompleksom heparyna–płytkowy czynnik 4 (PF4) metodami immunologicznymi; w przypadku stwierdzenia tych przeciwciał sugerujemy
przeprowadzenie testów czynnościowych, jeśli jest to możliwe (badania mało dostępne); w przypadku braku dostępności testów czynnościowych
dalsze decyzje należy podejmować na podstawie obrazu klinicznego i wyników testów immunologicznych.
8. U chorych z dużym prawdopodobieństwem wystąpienia VITT po szczepieniu szczepionką firmy AstraZeneca zalecamy NIESTOSOWANIE
heparyny ani wlewów koncentratu krwinek płytkowych.
9. U chorych z dużym prawdopodobieństwem wystąpienia VITT zalecamy stosowanie w leczeniu doustnych bezpośrednich inhibitorów
czynnika Xa (w Polsce apiksaban lub rywaroksaban) lub fondaparynuksu (zgodnie z Charakterystyką Produktu Leczniczego) oraz wlewów
dożylnych immunoglobulin (IVIG 1 g/kg mc./d i.v. min. przez 2 kolejne dni) i glikokortykosteroidów (np. metyloprednizolon 1 mg/kg mc./d) z regularnym monitorowaniem morfologii krwi i stężenia dimeru D, najlepiej pod nadzorem hematologa.
10. Zalecamy zgłaszanie wszystkich przypadków podejrzenia VITT, jako rzadkiego działania niepożądanego produktu leczniczego, do odpowiednich
organów zgodnie z wymogami ustawowymi.
Podsumowując, aktualne dane nadal wskazują, że korzyści ze szczepienia preparatem firmy AstraZeneca (Vaxzevria – przyp. red.) zdecydowanie
przewyższają ryzyko bardzo rzadko występujących działań niepożądanych, w tym incydentów zakrzepowo-zatorowych. Ryzyko zagrażającej
życiu zakrzepicy u chorych na COVID-19
jest natomiast bardzo duże. Po szczepieniu należy pamiętać o działaniach mogących zmniejszać ryzyko
incydentów żylnej choroby zakrzepowo-zatorowej, tj. unikać unieruchomienia, odpowiednio zwiększyć spożycie płynów. Osoby przyjmujące leki
przeciwkrzepliwe powinny kontynuować leczenie, nie przerywając go ani bezpośrednio przed szczepieniem, ani po zaszczepieniu.
Ryzyko rzadkich zdarzeń niepożądanych po szczepieniu zawsze trzeba rozpatrywać w kontekście prawdopodobieństwa zakażenia SARS-CoV-2 i ryzyka związanego ze skutkami zachorowania na COVID-19 (p. także s. 80 – przyp. red.). Na podstawie brytyjskich danych klinicznych (zgony) i populacyjnych badań seroepidemiologicznych (zakażenie SARS-CoV-2) z pierwszej połowy 2020 roku (I fala pandemii) oszacowano, że w populacji dorosłych ryzyko zgonu z powodu COVID-19 wynosi 9/1000 zakażonych SARS-CoV-2 i zwiększa się wraz z wiekiem od 5/1000 w grupie 45–64 lata przez 31/1000 w grupie 65–74 lata aż po 116/1000 wśród seniorów >74. roku życia.14 Według danych polskiego Ministerstwa Zdrowia z 26 marca br. – uwzględniając poprawkę, że w Polsce rzeczywista liczba zakażeń jest prawdopodobnie 4 razy większa od liczby tych oficjalnie wykrytych – ryzyko zgonu w przebiegu COVID-19 w populacji ogólnej (tzn. z uwzględnieniem dzieci) wynosi około 6/1000 zakażonych SARS-CoV-2, a aktualnie do szpitali w ciężkim stanie trafiają coraz młodsi dorośli chorzy, także bez czynników ryzyka zdrowotnego (choroby przewlekłe).15 Ponieważ u dzieci zgony z powodu COVID-19 są niezwykle rzadkie, rzeczywista śmiertelność z powodu zakażenia SARS-CoV-2 u dorosłych w Polsce jest większa niż wartość podana powyżej. Ryzyko hospitalizacji z powodu COVID-19 niezaszczepionego personelu medycznego mającego bezpośredni kontakt z pacjentami jest natomiast 3-krotnie większe niż w populacji ogólnej.16
Piśmiennictwo:
1. Cines D.B., Bussel J.B.: SARS-CoV-2 vaccine-induced immune thrombotic thrombocytopenia. N. Engl. J. Med., 2021; doi: 10.1056/NEJMe2 106 3152. Supplement to: Voysey M., Clemens S.A.C., Madhi S.A. i wsp.: Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet, 2020; doi. org/10.1016/S0140-6736(20)32 661–1
3. COVID-19 Vaccine AstraZeneca: PRAC preliminary view suggests no specific issue with batch used in Austria. www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-pracpreliminary-view-suggests-no-specific-issue-batch-used-austria (dostęp: 13.04.2021)
4. COVID-19 Vaccine AstraZeneca: PRAC investigating cases of thromboembolic events – vaccine’s benefits currently still outweigh risks – update. www.ema.europa.eu/en/news/ covid-19-vaccine-astrazeneca-prac-investigating-cases-thromboembolic-events-vaccin es-benefits (dostęp: 13.04.2021
5. COVID-19 Vaccine AstraZeneca: benefits still outweigh the risks despite possible link to rare blood clots with low blood platelets. www.ema.europa.eu/en/news/covid-19-vac cine-astrazeneca-benefits-still-outweigh-risks-despite-possible-link-rare-blood-clots (dostęp: 13.04.2021)
6. AstraZeneca’s COVID-19 vaccine: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets. www.ema.europa.eu/en/news/astrazenecas-covid19-vaccine-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood (dostęp: 13.04.2021)
7. AstraZeneca’s COVID-19 vaccine: benefits and risks in context. https://www.ema.europa. eu/en/news/astrazenecas-covid-19-vaccine-benefits-risks-context (dostęp: 26.04.2021)
8. Greinacher A., Thiele T., Warkentin T.E. i wsp.: Thrombotic thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N. Engl. J. Med., 2021; doi: 10.1056/NEJMoa2 104 840
9. Scully M., Singh D., Lown R. i wsp.: Pathologic antibodies to platelet factor 4 after ChAdOx1 nCoV-19 vaccination. N. Engl. J. Med., 2021; doi: 10.1056/NEJMoa2 105 385
10. Charakterystyka Produktu Leczniczego Vaxzevria. www.ema.europa.eu/en/documents/ product-information/vaxzevria-previously-covid-19-vaccine-astrazeneca-epar-product -information_pl.pdf (dostęp: 13.04.2021)
11. Interim statement of the COVID-19 subcommittee of the WHO Global Advisory Committee on Vaccine Safety on AstraZeneca COVID-19 vaccine. www.who.int/news/item/07-04-2 021-interim-statement-of-the-covid-19-subcommittee-of-the-who-global-advisory-co mmittee-on-vaccine-safety (dostęp: 13.04.2021)
12. Undas A., Podolak-Dawidziak M., Pruszczyk P. i wsp.: Uaktualnione stanowisko Sekcji ds. hemostazy Polskiego Towarzystwa Hematologów i Transfuzjologów w sprawie szczepionki przeciwko COVID-19 firmy AstraZeneca. 13.04.2021. www.mp.pl/zakrzepica/ wytyczneartykuly/wytyczne/263 793 (dostęp: 15.04.2021)
13. Guidance produced from the Expert Haematology Panel (EHP) focussed on Covid-19 Vaccine induced thrombosis and thrombocytopenia (VITT). Version 1.3. 07.04.2021. https://b-s-h.org.uk/media/19 530/guidance-version-13-on-mngmt-of-thrombosis-with-thrombocytopenia-occurring-after-c-19-vaccine_ 20 210 407.pdf (dostęp: 13.04.2021)
14. COVID-19: The Green Book, chapter 14a. www.gov.uk/government/publications/covid-19-the-green-book-chapter-14a (dostęp: 26.03.2021)
15. COVID-19: zachorowania w Polsce – aktualne dane. www.mp.pl/pacjent/choroby-zakazne/ koronawirus/koronawirus-warto-wiedziec/230 267 (dostęp: 26.03.2021)
16. Shah A.S.V., Wood R., Gribben C. i wsp.: Risk of hospital admission with coronavirus disease 2019 in healthcare workers and their households: nationwide linkage cohort study. BMJ, 2020; 371: m3582; http://dx.doi.org/10.1136/bmj.m3582
Pytanie 2. Czy szczepienie przeciwko COVID-19 preparatem wektorowym firmy Janssen/ Johnson & Johnson zwiększa ryzyko zdarzeń zakrzepowych?
Wektorowa szczepionka przeciwko COVID-19 firmy Janssen/Johnson & Johnson do tej pory była stosowana w ramach powszechnego programu szczepień w Stanach Zjednoczonych. Preparat ten jest również od niedawna dopuszczony do użycia w UE, a jego pierwsze dostawy dotarły już do Polski. W ramach rutynowego nadzoru nad bezpieczeństwem szczepień prowadzonego po wprowadzeniu preparatu do stosowania w praktyce do systemu biernego zgłaszania podejrzenia NOP (VAERS) w Stanach Zjednoczonych wpłynęły pojedyncze doniesienia o przypadkach bardzo rzadkich i nietypowych zdarzeń zakrzepowych przebiegających z małopłytkowością, które wystąpiły w związku z czasowym ze szczepieniem tym preparatem.
Zgodnie z aktualnymi danymi udostępnionymi przez CDC po spotkaniu Amerykańskiego Komitetu Doradczego ds. Szczepień (ACIP) w 23 kwietnia br., po podaniu 7 980 000 dawek tej szczepionki do VAERS zgłoszono 15 przypadków zdarzeń zakrzepowych przebiegających z małopłytkowością (w tym 12 pod postacią CVST), które wystąpiły w ciągu 6–15 dni po szczepieniu (wszystkie dotyczyły kobiet w wieku 18–59 lat).1,2 CDC zaznacza jednak, że 14-dniowy okres obserwacji po szczepieniu ukończono dla 3 466 166 (48%) podanych dawek, w przypadku pozostałych ewentualne zgłoszenia dotyczące zdarzeń zakrzepowych mogą jeszcze wpłynąć do VAERS.1,2 Dodatkowo 1 przypadek CVST odnotowano u 25-letniej kobiety uczestniczącej w przedrejestracyjnym badaniu klinicznym III fazy tego preparatu (pierwsze objawy pojawiły się 9 dni po szczepieniu, a u pacjentki potwierdzono występowanie przeciwciał anty-PF4, które obserwuje się u osób z HIT i w VITT po szczepionce Vaxzevria).3 W raporcie podkreślono, że CVST jest bardzo rzadkim zdarzeniem zakrzepowym i trudno dokładnie oszacować częstość jego występowania w populacji ogólnej (p. także pyt. 3. – przyp. red.). Ograniczając się jednak do grupy w tym samym wieku i płci, w której zgłaszano CVST po szczepieniu preparatem Janssen/Johnson & Johnson, ich liczba jest większa od spodziewanej na podstawie oceny częstości zdarzeń przed wprowadzeniem masowych szczepień przeciwko COVID-19.1,2
Informacje o tych nietypowych zdarzeniach zakrzepowych po tej szczepionce monitoruje również EMA, która zapewniła, że ściśle współpracuje w tej sprawie z amerykańskim Urzędem ds. Żywności i Leków (FDA) i innymi międzynarodowymi organami regulacyjnymi.4 W stanowisku z 20 kwietnia br. wskazała, że istnieje prawdopodobny związek między szczepieniem tym preparatem a występowaniem nietypowych zdarzeń zakrzepowych przebiegających z małopłytkowością. Jednocześnie podtrzymała swoją wcześniejszą opinię, że korzyści ze szczepienia preparatem firmy Johnson & Johnson przewyższają potencjalne ryzyko z nim związane.5 Nie potwierdzono, że związek ten ma charakter przyczynowy.
Po spotkaniu ACIP 23 kwietnia br. i pozytywnej rekomendacji ekspertów dotyczącej stosowania tej szczepionki ze względu na dodatni bilans korzyści i ryzyka w aktualnej sytuacji epidemiologicznej COVID-19 (p. tab. 1 i 2),6 FDA podtrzymała – po wcześniejszym okresowym wstrzymaniu szczepienia na czas analizy danych – zgodę na powszechne stosowanie preparatu firmy Janssen/Johnson & Johnson u dorosłych w Stanach Zjednoczonych we wszystkich grupach wiekowych7.
| Tabela 1. Szacowane na poziomie populacyjnym zmniejszenie liczby i odsetka (%) hospitalizacji, hospitalizacji na OIT lub zgonów z powodu COVID-19 po wznowieniu stosowania szczepionki przeciwko COVID-19 firmy Janssen/Johnson & Johnson przez 6 miesięcya i oczekiwana liczba przypadków zespołu zakrzepicy z małopłytkowością (TTS) w zależności od wieku szczepionych i ryzyka transmisji SARS-CoV-2 (CDC, Stany Zjednoczone, 2021 r.)b | ||||
|---|---|---|---|---|
| Korzyści i NOP po wznowieniu szczepień | Strategia szczepień po wznowieniu | |||
| szczepienie zalecane ≥18. rż. | szczepienie zalecane ≥50. rż. | |||
| małe ryzyko transmisji SARS-CoV-2 | średnie ryzyko transmisji SARS-CoV-2 | małe ryzyko transmisji SARS-CoV-2 | średnie ryzyko transmisji SARS-CoV-2 | |
| oczekiwana liczba osób szczepionych preparatem firmy Janssen/ Johnson & Johnson | 9,8 mln | 3,6 mln | ||
| korzyści – liczba przypadków, którym można zapobiec (% zmniejszeniac) | hospitalizacja | 3926 (1,4) | 9395 (1,6) | 1361 (0,5) | 3532 (0,6) |
| hospitalizacja na OIT | 928 (1,4) | 2,236 (1,5) | 295 (0,4) | 799 (0,5) |
| zgon | 586 (1,6) | 1435 (1,8) | 54 (0,1) | 257 (0,3) |
| NOP | ||||
| oczekiwana liczba przypadków TTS | 26 | 26 | 2 | 2 |
| a Wznowienie szczepień po 10 dniach przerwy, która rozpoczęła się 13 kwietnia 2021 r. (https://emergency.cdc.gov/han/2021/han00442.asp).
b Zastosowany model ocenia bezpośrednie i pośrednie efekty wznowienia szczepień preparatem firmy Janssen/Johnson & Johnson przy założeniu tempa realizacji szczepień na poziomie 50% (w porównaniu z okresem przed wstrzymaniem stosowaniem preparatu) wśród wszystkich dorosłych w wieku ≥18 lat lub tylko wśród dorosłych w wieku ≥50 lat w porównaniu z rezygnacją z tego szczepienia. W modelu uwzględniono zarówno małe, jak i średnie ryzyko transmisji SARS-CoV-2 oparte na różnych założeniach stosowania niefarmakologicznych metod zapobiegania zakażeniu w okresie objętym modelowaniem. c w porównaniu z rezygnacją z tego szczepienia CDC – Centers for Disease Control and Prevention, NOP – niepożądany odczyn poszczepienny, OIT – oddział intensywnej terapii, TTS – zespół zakrzepicy z małopłytkowością na podstawie 6. poz. piśmiennictwa | ||||
| Tabela 2. Szacowane na poziomie indywidualnym zmniejszenie liczby hospitalizacji, hospitalizacji na OIT i zgonów z powodu COVID-19 po wznowieniu stosowania szczepionki przeciwko COVID-19 firmy Janssen/Johnson & Johnson przez miesiąca i oczekiwana liczba przypadków zespołu zakrzepicy z małopłytkowością (TTS) na milion podanych dawek w zależności od płci i wieku szczepionych osób (CDC, Stany Zjednoczone, 2021 r.)b | ||||
|---|---|---|---|---|
| Korzyści i NOP po wznowieniu szczepień | Liczba przypadków / milion podanych dawekc | |||
| kobiety | mężczyźni | |||
| 18–49 lat | ≥50 lat | 18–49 latd | ≥50 lat | |
| korzyści – liczba przypadków, którym można zapobiec | ||||
| hospitalizacja | 297 | 2454 | 272 | 2821 |
| hospitalizacja na OIT | 56 | 661 | 51 | 760 |
| zgon | 6 | 394 | 6 | 471 |
| NOP | ||||
| oczekiwana liczba przypadków TTS | 7 | 1 | 1 | 0 |
| a Wznowienie szczepień po 10 dniach przerwy, która rozpoczęła się 13 kwietnia 2021 r.
(https://emergency.cdc.gov/han/2021/han00442.asp).
b W analizie oceniono bezpośrednie korzyści i NOP na milion podanych dawek szczepionki przeciwko COVID-19 firmy Janssen/Johnson & Johnson w ciągu 30 dni po szczepieniu. c w porównaniu z rezygnacją z tego szczepienia d W analizie uwzględniono 1 przypadek TTS, który wystąpił u mężczyzny w wieku 18–49 lat uczestniczącego w przedrejestracyjnym badaniu III fazy. CDC – Centers for Disease Control and Prevention, NOP – niepożądany odczyn poszczepienny, OIT – oddział intensywnej terapii, TTS – zespół zakrzepicy z małopłytkowością na podstawie 6. poz. piśmiennictwa | ||||
Piśmiennictwo:
1. Oliver S.: Thrombocytopenic thrombosis after Janssen vaccine: Work Group Interpretation. www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-04/05-COVID-Oliver-508. pdf (dostęp: 16.04.2021)2. Shimabukuro T.: Thrombosis with thrombocytopenia syndrome (TTS) following Janssen COVID-19 vaccine. Advisory Committee on Immunization Practices (ACIP). https://www. cdc.gov/vaccines/acip/meetings/downloads/slides-2021-04-23/03-COVID-Shimabukuro-508. pdf (dostęp: 24.04.2021)
3. Cines D.B., Bussel J.B.: SARS-CoV-2 vaccine–induced immune thrombotic thrombocytopenia. N. Engl. J. Med., 2021; doi: 10.1056/NEJMe2 106 315
4. COVID-19 Vaccine Janssen: assessment of very rare cases of unusual blood clots with low platelets continues. www.ema.europa.eu/en/news/covid-19-vaccine-janssen-assessme nt-very-rare-cases-unusual-blood-clots-low-platelets-continues (dostęp: 16.04.2021)
5. COVID-19 Vaccine Janssen: EMA finds possible link to very rare cases of unusual blood clots with low blood platelets. www.ema.europa.eu/en/news/covid-19-vaccine-janssen-ema-finds-possible-link-very-rare-cases-unusual-blood-clots-low-blood (dostęp: 21.04.2021)
6. MacNeil J.R., Su J.R., Broder K.R. i wsp.: Updated recommendations from the Advisory Committee on Immunization Practices for use of the Janssen (Johnson & Johnson) COVID-19 vaccine after reports of thrombosis with thrombocytopenia syndrome among vaccine recipients – United States, April 2021. MMWR, 2021; 70 (27.04.2021); www.cdc. gov/mmwr/volumes/70/wr/pdfs/mm7017e4-H.pdf (dostęp: 27.04.2021) 7. FDA and CDC lift recommended pause on Johnson & Johnson (Janssen) COVID-19 vaccine use following thorough safety review. https://www.fda.gov/news-events/press-announcements/ fda-and-cdc-lift-recommended-pause-johnson-johnson-janssen-covid-19-vaccine-use-following-thorough (dostęp: 26.04.2021)
Pytanie 3. Jak często występuje zakrzepica żył mózgowych lub trzewnych w przebiegu COVID-19 i czy zdarza się po szczepionkach mRNA przeciwko COVID-19?
Populacyjny nadzór nad bezpieczeństwem szczepień ujawnił związek między szczepieniem przeciwko COVID-19 a występowaniem VITT, głównie pod postacią CVST. Obserwacje dotyczą wektorowej szczepionki Vaxzevria (AstraZeneca), ale pojedyncze przypadki CVST zgłaszano również w Stanach Zjednoczonych po podaniu wektorowego preparatu firmy Janssen/Johnson & Johnson. Do EMA wpłynęły też zgłoszenia 35 prawdopodobnych przypadków CVST na 54 miliony podanych dawek szczepionki Comirnaty (Pfizer) oraz 5 prawdopodobnych (choć jeszcze niezweryfikowanych) przypadków CVST na 4 miliony podanych dawek preparatu mRNA Moderny.1 Z kolei w ramach nadzoru nad bezpieczeństwem szczepień w Stanach Zjednoczonych do systemu Vaccine Safety Datalink wpłynęły zgłoszenia 5 przypadków CVST po podaniu 2,7 miliona dawek szczepionki Comirnaty i 2,5 miliona dawek preparatu mRNA Moderny, jednak w żadnym z tych przypadków nie stwierdzono małopłytkowości towarzyszącej VITT.2
Ryzyko VITT zawsze trzeba rozpatrywać w kontekście ryzyka związanego z zachorowaniem na COVID-19 i jej powikłań (p. tab. 1 i 2, a także s. 80 – przyp. red.). Taki cel postawił sobie zespół naukowców z Uniwersytetu Oksfordzkiego w Wielkiej Brytanii, a wyniki autorzy ogłosili ostatnio w postaci nierecenzowanego jeszcze artykułu na platformie preprintowej uniwersytetu.3 Dane te należy więc interpretować ostrożnie, jako wstępne, także z uwagi na metodykę obarczoną dużym ryzykiem błędów systematycznych oraz ograniczeniem analizy do zdarzeń zakrzepowych bez rozpatrywania ich przyczyn (np. nie każdy przypadek CVST jest związany z VITT).
Taquet i wsp. przeprowadzili badanie kohortowe z retrospektywnym zbieraniem danych, w którym ocenili i porównali częstość występowania CVST i zakrzepicy żyły wrotnej (PVT) lub innych żył trzewnych w ciągu 14 dni po zachorowaniu na COVID-19 z częstością występowania tych zdarzeń po zachorowaniu na grypę i szczepieniu przeciwko COVID-19 pierwszą dawką preparatów mRNA (Comirnaty [Pfizer] lub mRNA Moderny). Wyniki porównano z ryzykiem takich zdarzeń zakrzepowych po podaniu wektorowego preparatu Vaxzevria (AstraZeneca) w analogicznym okresie narażenia. Dane do badania uzyskano z prywatnej sieci TriNetX Analytics Network, obejmującej 54 organizacje opieki zdrowotnej (głównie w Stanach Zjednoczonych) i populację prawie 81 milionów osób (ubezpieczonych i nieubezpieczonych), która legalnie działa w Stanach Zjednoczonych, a jej elektroniczna baza danych była już wykorzystywana w przeszłości do kilku publikacji naukowych. W celu oszacowania ryzyka CVST lub PVT po szczepieniu preparatem Vaxzevria sięgnięto po dane dotyczące zweryfikowanych przypadków VITT opublikowane przez EMA.
W analizowanej populacji w okresie od 20 stycznia do 25 marca br. zachorowanie na COVID-19 potwierdzono u 513 284 osób (śr. wiek 46,6 lat; 54,8% kobiety), na grypę zachorowały 172 472 osoby, a 489 871 osób otrzymało szczepienie przeciwko COVID-19 preparatem mRNA Comirnaty (Pfizer) lub firmy Moderna. Do 14 dni po zachorowaniu na COVID-19 u 20 osób rozpoznano CVST – ryzyko bezwzględne oszacowano na 39 przypadków / 1 000 000 osób (95% CI: 25,2–60,2) i było ono istotnie większe niż po zachorowaniu na grypę (ryzyko bezwzględne: 0 przypadków / 1 000 000 osób [95% CI: 0,0–22,2]; ryzyko względne [RR]: 6,73), a także >6-krotnie większe niż po szczepieniu przeciwko COVID-19 preparatem mRNA (ryzyko bezwzględne: 4,1/1 000 000 [95% CI: 1,1–14,9]; RR: 6,36). Ryzyko CVST po zachorowaniu na COVID-19 było również znacznie większe niż ryzyko po szczepieniu preparatem Vaxzevria (ryzyko bezwzględne: 5 przypadków / 1 000 000 osób [95% CI: 4,3–5,8]) i ogólne ryzyko CVST w populacji objętej analizą (ryzyko bezwzględne: 0,41/1 000 000) oraz większe niż podstawowe ryzyko CVST w populacji ogólnej Stanów Zjednoczonych (ryzyko bezwzględne: 0,53–0,77/1 000 000).
Z kolei w ciągu 14 dni od zachorowania na COVID-19 u 224 osób rozpoznano PVT – ryzyko bezwzględne oszacowano na 436,4 przypadków / 1 000 000 osób (95% CI: 382,9– 497,4) i także było ono istotnie większe niż po zachorowaniu na grypę (ryzyko bezwzględne: 98,4/1 000 000 [95% CI: 61,4–157,6]; RR: 4,43 [95% CI: 2,71–7,26]) i prawie 10-krotnie większe niż po szczepieniu przeciwko COVID-19 preparatami mRNA (ryzyko bezwzględne: 44,9/1 000 000 [95% CI: 29,7–68]; RR: 9,72 [95% CI: 6,27–15]). Ryzyko wystąpienia PVT po zachorowaniu na COVID-19 było również większe niż ryzyko zakrzepicy żył trzewnych po szczepieniu preparatem Vaxzevria (ryzyko bezwzględne: 1,6/1 000 000 [95% CI: 1,2–2]) i większe niż podstawowe ryzyko PVT w całej wyjściowej populacji objętej analizą (4,1 przypadku / 1 000 000 osób).
Wykazano również, że ryzyko CVST po zachorowaniu na COVID-19 było istotnie większe u osób z chorobami układu krążenia w wywiadzie, zwłaszcza ze zwężeniem/niedrożnością tętnic mózgowych lub krwawieniem wewnątrzczaszkowym. W porównaniu z innymi chorymi na COVID-19 u pacjentów z CVST po zachorowaniu na COVID-19 częściej obserwowano zwiększone stężenie dimerów D, a u chorych z PVT po zachorowaniu na COVID-19 częściej występowały zmniejszone stężenie fibrynogenu i zmniejszona liczba płytek krwi. Współczynnik śmiertelności wśród pacjentów, u których w ciągu 14 dni od zachorowania na COVID-19 wystąpiła CVST, wynosił 20% (95% CI: 8–41,6), a wśród pacjentów, u których w analogicznym okresie rozpoznano PVT – 18,3% (95% CI: 13,8–23,9).
Autorzy badania wyciągnęli wniosek, że zachorowanie na COVID-19 zwiększa ryzyko wystąpienia CVST dużo bardziej niż zachorowanie na grypę lub szczepienie przeciwko COVID-19 preparatami mRNA i wydaje się, że jest również znacznie większe niż po szczepieniu preparatem Vaxzevria (ryc. 2). Wyniki przedstawionej analizy podkreślają ryzyko wystąpienia ciężkich zdarzeń zakrzepowych w wyniku zachorowania na COVID-19 i mogą pomóc ocenić bilans korzyści oraz ryzyko związane ze stosowaniem aktualnie dostępnych szczepionek przeciwko COVID-19. Autorzy wskazali również, że CVST jest zdarzeniem zakrzepowym, które bardzo rzadko występuje w populacji ogólnej, dlatego aby potwierdzić otrzymane wyniki, potrzebne są kolejne badania obejmujące większą populację.
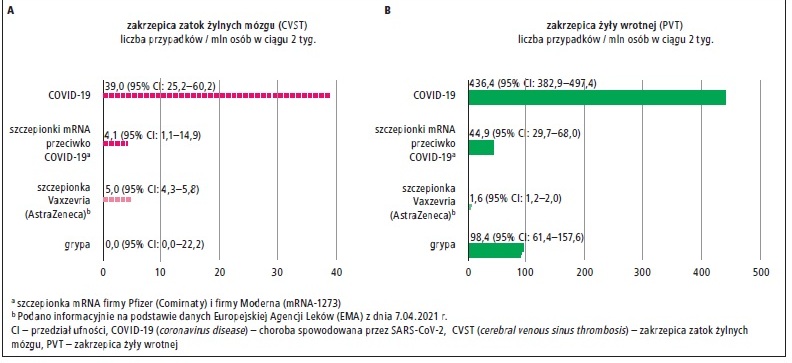
Ryc. 2. Liczba przypadków (A) zakrzepicy zatok żylnych mózgu (CVST) i (B) zakrzepicy żyły wrotnej (PVT) na mln osób w ciągu 2 tygodni po różnych zdarzeniach zdrowotnych (na podstawie: Taquet i wsp.: Cerebral venous thrombosis: a retrospective cohort study of 513,284 confirmed COVID-19 cases and a comparison with 489,871 people receiving a COVID-19 mRNA vaccine. https://osf.io/a9jdq/ [dostęp: 1.04.2021])
Piśmiennictwo:
1. Cines D.B., Bussel J.B.: SARS-CoV-2 vaccine-induced immune thrombotic thrombocytopenia. N. Engl. J. Med., 2021; doi: 10.1056/NEJMe2 106 3152. Shimabukuro T.: Thrombosis with thrombocytopenia syndrome (TTS) following Janssen COVID-19 vaccine. Advisory Committee on Immunization Practices (ACIP). https://www. cdc.gov/vaccines/acip/meetings/downloads/slides-2021-04-23/03-COVID-Shimabukuro-508. pdf (dostęp: 24.04.2021)
3. Taquet M., Husain M., Geddes R.J. I wsp.: Cerebral venous thrombosis: a retrospective cohort study of 513,284 confirmed COVID-19 cases and a comparison with 489,871 people receiving a COVID-19 mRNA vaccine. https://osf.io/a9jdq/ (dostęp: 19.04.2021)















