Opracowała: lek. Iwona Rywczak
Skróty: ACIP – Advisory Committee on Immunization Practices, GMC (geometric mean concentration) – średnia geometryczna stężenia, GMT (geometric mean titer) – średnia geometryczna miana, HSCT (hematopoietic stem cell transplantation) – przeszczepienie macierzystych komórek krwiotwórczych, IChP – inwazyjna choroba pneumokokowa, OPA – opsonofagocytoza, OZUŚ – ostre zapalenie ucha środkowego, PCV (pneumococcal conjugate vaccine) – skoniugowana szczepionka przeciwko pneumokokom, PCV-7 (7-valent pneumococcal conjugate vaccine) – 7-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-13 (13-valent pneumococcal conjugate vaccine) – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-15 (15-valent pneumococcal conjugate vaccine) – 15-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-20 (20-valent pneumococcal conjugate vaccine) – 20-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 (23-valent pneumococcal polysaccharide vaccine) – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom
Wprowadzenie
Mimo że program szczepień przeciwko pneumokokom odniósł sukces, Streptococcus pneumoniae jest nadal w USA częstą przyczyną zapalenia płuc i ostrego zapalenia ucha środkowego (OZUŚ) oraz zakażeń inwazyjnych, takich jak zapalenie opon mózgowo-rdzeniowych i sepsa.
W 2010 roku w USA zarejestrowano 13-walentną skoniugowaną szczepionkę przeciwko pneumokokom (PCV-13), która zastąpiła stosowaną od 2000 roku szczepionkę 7-walentną (PCV-7). W 2022 roku rozszerzono wskazania rejestracyjne 15-walentnej skoniugowanej szczepionki przeciwko pneumokokom (PCV-15), co skłoniło Advisory Committee on Immunization Practices (ACIP) do zmiany zaleceń dotyczących szczepienia dzieci przeciwko pneumokokom w zakresie stosowania PCV-15 jako alternatywy dla PCV-13. W kwietniu 2023 roku Food and Drug Administration (FDA) dopuścił 20-walentną skoniugowaną szczepionkę przeciwko pneumokokom (PCV-20) do stosowania u dzieci w wieku od 6 tygodni do 17 lat, opierając się na wynikach badań porównujących immunogenność i bezpieczeństwo PCV-20 z immunogennością i bezpieczeństwem PCV-13. Kolejnym krokiem było zatwierdzenie w czerwcu 2023 roku nowych zaleceń ACIP obejmujących stosowanie PCV-20 w tej grupie wiekowej. W nowych zaleceniach wśród czynników ryzyka wymieniono również przewlekłą chorobę nerek (nie tylko dializoterapię i zespół nerczycowy), przewlekłą chorobę wątroby oraz astmę w stopniu umiarkowanym i ciężkim (niezależnie od stosowania doustnych glikokortykosteroidów w dużej dawce).
Metodyka
Grupa robocza ds. szczepień przeciwko pneumokokom działająca przy ACIP oceniła jakość danych naukowych dotyczących bezpieczeństwa i immunogenności PCV-20 u dzieci zgodnie z systemem Grading of Recommendations Assessment, Development and Evaluation (GRADE). Wykorzystując system Evidence to Recommendation (EtR) Framework, grupa robocza dokonała przeglądu danych naukowych dotyczących korzyści i potencjalnego ryzyka stosowania PCV-20 u dzieci. Wzięto pod uwagę epidemiologię zakażeń pneumokokowych, ich znaczenie jako problemu zdrowia publicznego, wartości ważne dla populacji docelowych i ich preferencje, kwestie dotyczące wykorzystania dostępnych zasobów, akceptację zaleceń oraz możliwość ich zastosowania w praktyce.
Aktualne zalecenia dotyczące szczepienia dzieci przeciwko pneumokokom
Zalecenia podsumowano w tabelach 1–3 oraz na rycinie 1 i 2.
| Tabela 1. Zalecenia (2023) Advisory Committee on Immunization Practices dotyczące stosowania skoniugowanych szczepionek przeciwko pneumokokom u dzieci | |
|---|---|
| Wiek i grupy ryzyka | Zalecenia |
| <24 mies. | Wszystkim dzieciom w wieku 2–23 mies. zaleca się podać PCV-15 lub PCV-20 zgodnie z obowiązującym wcześniej schematem dla szczepionek skoniugowanych. Jeżeli zgodnie z obowiązującym programem szczepień dziecko powinno otrzymać PCV, a PCV-15 i PCV-20 nie są dostępne, szczepienie można zrealizować z użyciem PCV-13 (wg polskiego PSO PCV-10 – przyp. red.) wg wcześniej obowiązujących zaleceń. Jeżeli dziecko rozpoczęło szczepienie z użyciem PCV-13, schemat można dokończyć PCV-15 lub PCV-20; nie jest konieczne podawanie dodatkowych dawek i rozpoczynanie od nowa szczepienia przeciwko pneumokokom. Dzieciom, które otrzymały pełny schemat szczepienia PCV-13 lub PCV-15, nie należy podawać dodatkowej dawki PCV-20. |
| zdrowe dzieci w wieku 24–59 mies., które nie otrzymały pełnego szczepienia PCVa | Zaleca się podać 1 dawkę PCV-15 lub PCV-20. Nie jest wskazane podawanie dodatkowej dawki PCV-15 lub PCV-20 dzieciom, które otrzymały 4 dawki PCV-13 lub pełny schemat szczepienia PCV-13 należny dla wieku. |
| dzieci w wieku 24–71 mies. z ≥1 czynnikiem ryzykab | Należy podać PCV-15 lub PCV-20 zgodnie z wcześniej obowiązującym schematem dla szczepionek skoniugowanych. Jeżeli zgodnie z obowiązującym programem szczepień dziecko powinno otrzymać PCV, a PCV-15 i PCV-20 nie są dostępne, szczepienie można zrealizować z użyciem PCV-13 wg wcześniej obowiązujących zaleceń. |
| dzieci w wieku 2–18 lat z ≥1 czynnikiem ryzyka,b które otrzymały pełne szczepienie PCV przed ukończeniem 6. rż. | Podano ≥1 dawkę PCV-20: nie zaleca się żadnych dodatkowych dawek szczepionek przeciwko pneumokokom; zalecenie to może się zmienić w przypadku pojawienia się nowych danych. Podano PCV-13 lub PCV-15: zaleca się podać 1 dawkę PCV-20 lub PPSV-23. |
| dzieci w wieku 6–18 lat z ≥1 czynnikiem ryzyka,b które nie były szczepione PCV-13, PCV-15 lub PCV-20 | Zaleca się podać 1 dawkę PCV-15 lub PCV-20. Jeżeli wcześniej podano PCV-7 i/lub PPSV-23, zaleca się podać 1 dawkę PCV-15 lub PCV-20 w odstępie ≥8 tyg. od ostatniej dawki szczepionki przeciwko pneumokokom. Szczepienie PCV-15 należy uzupełnić 1 dawką PPSV-23, jeżeli nie zrobiono tego wcześniej. Jeżeli podano PCV-20, nie jest konieczne późniejsze szczepienie PPSV-23. |
| dzieci po HSCT | Rozpoczęcie szczepienia 3–6 mies. po HSCT: 3 dawki PCV-20 w odstępie 4 tyg. Należy podać czwartą dawkę PCV-20 po upływie ≥6 mies. od trzeciej dawki lub ≥12 mies. od HSCT, w zależności od tego, co nastąpiło później. Biorcy HSCT, którzy rozpoczęli szczepienie przeciwko pneumokokom PCV-13 lub PCV-15, mogą ukończyć schemat 4-dawkowy PCV-20 bez podawania dodatkowych dawek. Jeżeli PCV-20 nie jest dostępna, można podać 3 dawki PCV-15 w odstępie 4 tyg., rozpoczynając szczepienie 3–6 mies. po HSCT, a następnie 1 dawkę PPSV-23 ≥12 po HSCT; dzieciom z GvHD jako czwartą dawkę można podać PCV-15 z uwagi na mniejszą szansę na uzyskanie odpowiedzi na PPSV-23. |
| a Zdrowym dzieciom w wieku ≥5 lat nie zaleca się rutynowo podawać PCV. b Do czynników ryzyka zalicza się: wyciek płynu mózgowo-rdzeniowego, przewlekłą chorobę serca, nerek (nie dotyczy stanów wymagających leczenia nerkozastępczego i zespołu nerczycowego, które zaliczono do niedoborów odporności), wątroby, płuc (w tym astmę w stopniu umiarkowanym i ciężkim), wszczepienie implantu ślimakowego, cukrzycę, niedobory odporności (zespół nerczycowy, leczenie nerkozastępcze, asplenię wrodzoną lub nabytą, lub zaburzenia funkcji śledziony, wrodzone lub nabyte niedobory odporności, choroby wymagające leczenia immunosupresyjnego lub radioterapii, w tym nowotwory złośliwe, białaczki, chłoniaki, choroba Hodgkina, przeszczepienie narządu miąższowego, zakażenie HIV, niedokrwistość sierpowatokrwinkowa lub inne hemoglobinopatie). Dzieciom obarczonym tymi czynnikami ryzyka, które zaszczepiono PCV-13 lub PCV-15, zaleca się również podać PPSV-23. GvHD – choroba przeszczep przeciwko gospodarzowi, HSCT – przeszczepienie macierzystych komórek krwiotwórczych, PCV – skoniugowana szczepionka przeciwko pneumokokom, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-15 – 15-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-20 – 20-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom | |
| Tabela 2. Zalecany schemat szczepienia skoniugowanymi szczepionkami przeciwko pneumokokom w zależności od wieku dziecka, stanu zdrowia i przebytych szczepień (USA, 2023) | |||
|---|---|---|---|
| Wiek/stan zdrowia | Liczba podanych wcześniej dawek PCV-13/PCV-15/PCV-20 | Zalecany schemat szczepienia PCV-15/PCV-20a,b | Łączna liczba dawek PCV-13/PCV-15/PCV-20 niezbędna do wykonania pełnego schematu szczepienia do ukończenia 24. mż. |
| wszystkie dzieci (zdrowe i z czynnikami ryzyka) | |||
| 2–6 mies. | 0 | 4 dawki: 3 w odstępie 8 tyg., ostatnia dawka w wieku 12–15 mies. | 4 |
| 1 | 3 dawki: 2 w odstępie 8 tyg., ostatnia dawka w wieku 12–15 mies. | 4 | |
| 2 | 2 dawki: 1 po upływie 8 tyg. od poprzedniej dawki, ostatnia dawka w wieku 12–15 mies., ale nie wcześniej niż po 8 tyg. | 4 | |
| 3 | 1 dawka w wieku 12–15 mies. | 4 | |
| 7–11 mies. | 0 (w wieku <7 mies.) | 3 dawki: 2 w odstępie 8 tyg., ostatnia dawka w wieku 12–15 mies. | 3 |
| 1 lub 2 (w wieku <7 mies.) | 2 dodatkowe dawki: 1 po upływie 8 tyg. od poprzedniej dawki, ostatnia dawka w wieku 12–15 mies., ale nie wcześniej niż po 8 tyg. | 3 lub 4 | |
| 3 (w wieku <7 mies.) | 1 dodatkowa dawka w wieku 12–15 mies. | 4 | |
| 1 (w wieku ≥7 mies.) | 2 dodatkowe dawki: 1 po upływie 8 tyg. od poprzedniej dawki, ostatnia dawka w wieku 12–15 mies., ale nie wcześniej niż po 8 tyg. | 3 | |
| 2 (w wieku ≥7 mies.) | 1 dodatkowa dawka w wieku 12–15 mies. po upływie ≥8 tyg. od ostatniej dawki | 3 | |
| 12–23 mies. | 0 (w wieku <12 mies.) | 2 dawki w odstępie 8 tyg. | 2 |
| 1 (w wieku <12 mies.) | 2 dodatkowe dawki: 1 po upływie ≥8 tyg. od poprzedniej dawki, ostatnia dawka po upływie ≥8 tyg. | 3 | |
| 2 lub 3 (w wieku <12 mies.) | 1 dodatkowa dawka po upływie ≥8 tyg. od poprzedniej dawki | 3 lub 4 | |
| 1 (w wieku ≥12 mies.) | 1 dawka po upływie ≥8 tyg. od ostatniej dawkib | 2 | |
| zdrowe dzieci | |||
| 24–59 mies. | 0 lub brak pełnego szczepienia przed ukończeniem 24. mż. | 1 dodatkowa dawka po upływie ≥8 tyg. od poprzedniej dawki | – |
| 5–18 lat | 0 lub brak pełnego szczepienia przed ukończeniem 24. mż. | nie zaleca się dodatkowego szczepieniac | – |
| dzieci i młodzież z grupy ryzykad | |||
| 24–71 mies.e | 0 lub brak pełnego szczepieniaf i <3 dawki przed ukończeniem 24. mż. | 2 dawki: 1 po upływie ≥8 tyg. od poprzedniej dawki, ostatnia dawka po upływie ≥8 tyg. | – |
| 3 (wszystkie w wieku <12 mies.) | 1 dodatkowa dawka po upływie ≥8 tyg. od poprzedniej dawki | – | |
| 6–18 lat | 0 | 1 dawkaf,g | – |
| a Jeżeli zgodnie z obowiązującym programem szczepień dziecko powinno otrzymać PCV, a PCV-15 i PCV-20 nie są dostępne, szczepienie można realizować PCV-13 wg wcześniej obowiązujących zaleceń. b Minimalny odstęp między dawkami wynosi 8 tyg., z wyjątkiem dzieci szczepionych w wieku <1. rż., u których trwa on 4 tyg. Minimalny wiek dla podania 1. dawki to 6 tyg. c Zdrowym dzieciom w wieku ≥5 lat nie zaleca się rutynowego szczepienia PCV. d Do czynników ryzyka zalicza się: wyciek płynu mózgowo-rdzeniowego, przewlekłą chorobę serca, nerek (nie dotyczy stanów wymagających leczenia nerkozastępczego i zespołu nerczycowego, które zaliczono do niedoborów odporności), wątroby, płuc (w tym astmę w stopniu umiarkowanym i ciężkim), wszczepienie implantu ślimakowego, cukrzycę, niedobory odporności (zespół nerczycowy, leczenie nerkozastępcze, asplenię wrodzoną lub nabytą, lub zaburzenia funkcji śledziony, wrodzone lub nabyte niedobory odporności, choroby wymagające leczenia immunosupresyjnego lub radioterapii, w tym nowotwory złośliwe, białaczki, chłoniaki, choroba Hodgkina, przeszczepienie narządu miąższowego, zakażenie HIV, niedokrwistość sierpowatokrwinkowa lub inne hemoglobinopatie). e Tym dzieciom zaleca się również podanie 1 dawki PCV-20 lub ≥1 dawki PPSV-23, jeżeli nie podano PCV-20 w ramach zalecanego schematu szczepienia PCV. f P. kolumna: „Łączna liczba dawek PCV-13/PCV-15/PCV-20 niezbędna do wykonania pełnego schematu szczepienia do ukończenia 24. mż.” g W przypadku wyboru PCV-15, jeżeli dziecko nie było wcześniej szczepione szczepionką polisacharydową, po upływie ≥8 tyg. należy jeszcze podać 1 dawkę PPSV-23. Jeżeli wybierze się PCV-20, dodatkowe szczepienie PPSV-23 nie jest konieczne. PCV – skoniugowana szczepionka przeciwko pneumokokom, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-15 – 15-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-20 – 20-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom | |||
| Tabela 3. Zalecenia dotyczące stosowania skoniugowanych szczepionek przeciwko pneumokokom u nieszczepionych dzieci i młodzieży w zależności od czynników ryzyka | ||||
|---|---|---|---|---|
| PCVa dla dzieci w wieku <6 lat | PCVa dla osób w wieku 6–18 lat | PPSV-23 dla osób w wieku ≥2 lat wcześniej nieszczepionych PCV-20 | ||
| czynnik ryzyka/choroba przewlekła | zalecane | zalecane | zalecane | 1 dawka przypominająca 5 lat po pierwszej dawce |
| choroby przewlekłe | ||||
| przewlekła choroba sercab | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | nie |
| przewlekła choroba nerek (wyłączając pacjentów dializowanych i z zespołem nerczycowym) | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | nie |
| przewlekła choroba wątroby | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | nie |
| przewlekła choroba płuc (w tym astma przewlekła w stopniu umiarkowanymvi ciężkim) | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | nie |
| cukrzyca | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | nie |
| wyciek płynu mózgowo-rdzeniowego | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | nie |
| implant ślimakowy | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | nie |
| choroby przebiegające z niedoborem odporności | ||||
| dializoterapia lub zespół nerczycowy | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | tak, jeśli nie podano wcześniej PCV-20 |
| asplenia wrodzona lub nabyta, dysfunkcja śledziony | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | tak, jeśli nie podano wcześniej PCV-20 |
| wrodzony lub nabyty niedobór odpornościc | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | tak, jeśli nie podano wcześniej PCV-20 |
| choroby wymagające leczenia immunosupresyjnego lub radioterapiid | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | tak, jeśli nie podano wcześniej PCV-20 |
| zakażenie HIV | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | tak, jeśli nie podano wcześniej PCV-20 |
| niedokrwistość sierpowatokrwinkowa, inne hemoglobinopatie | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | tak, jeśli nie podano wcześniej PCV-20 |
| przeszczepienie narządu miąższowego | tak | tak | tak, jeśli podano wcześniej PCV-13 lub PCV-15 | tak, jeśli nie podano wcześniej PCV-20 |
| a można zastosować PCV-15 lub PCV-20 b Zalecenia mają szczególne znaczenie u dzieci z siniczą wrodzoną wadą serca i niewydolnością serca. c w tym niedobór odporności zależny od limfocytów B lub T, niedobór składowych układu dopełniacza (zwłaszcza C1, C2, C3 i C4) oraz zaburzenia układu fagocytarnego (z wyjątkiem przewlekłej choroby ziarniniakowej) d w tym nowotwory złośliwe, białaczki, chłoniaki ziarnicze i nieziarnicze PCV – skoniugowana szczepionka przeciwko pneumokokom, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-15 – 15-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-20 – 20-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom | ||||
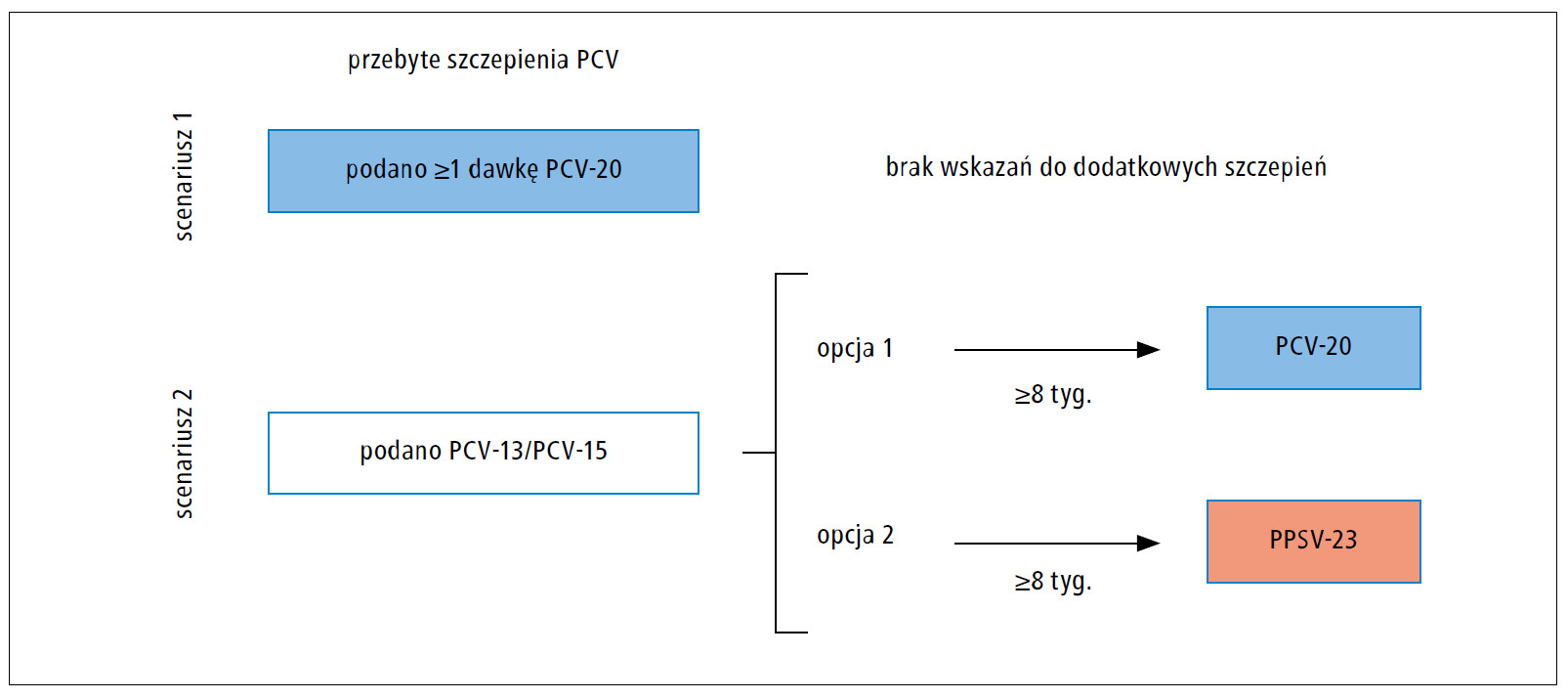
Ryc. 1. Zalecane szczepienia przeciwko pneumokokom u osób w wieku 2–18 lat z chorobami przewlekłymi (przewlekła choroba serca, nerek [nie dotyczy pacjentów dializowanych i zespołu nerczycowego], wątroby, płuc [w tym astma w stopniu umiarkowanym i ciężkim], cukrzyca), wyciekiem płynu mózgowo-rdzeniowego lub implantem ślimakowym, które otrzymały wszystkie zalecane dawki PCV przed ukończeniem 6 lat.
PCV – skoniugowana szczepionka przeciwko pneumokokom, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-15 – 15-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-20 – 20-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom
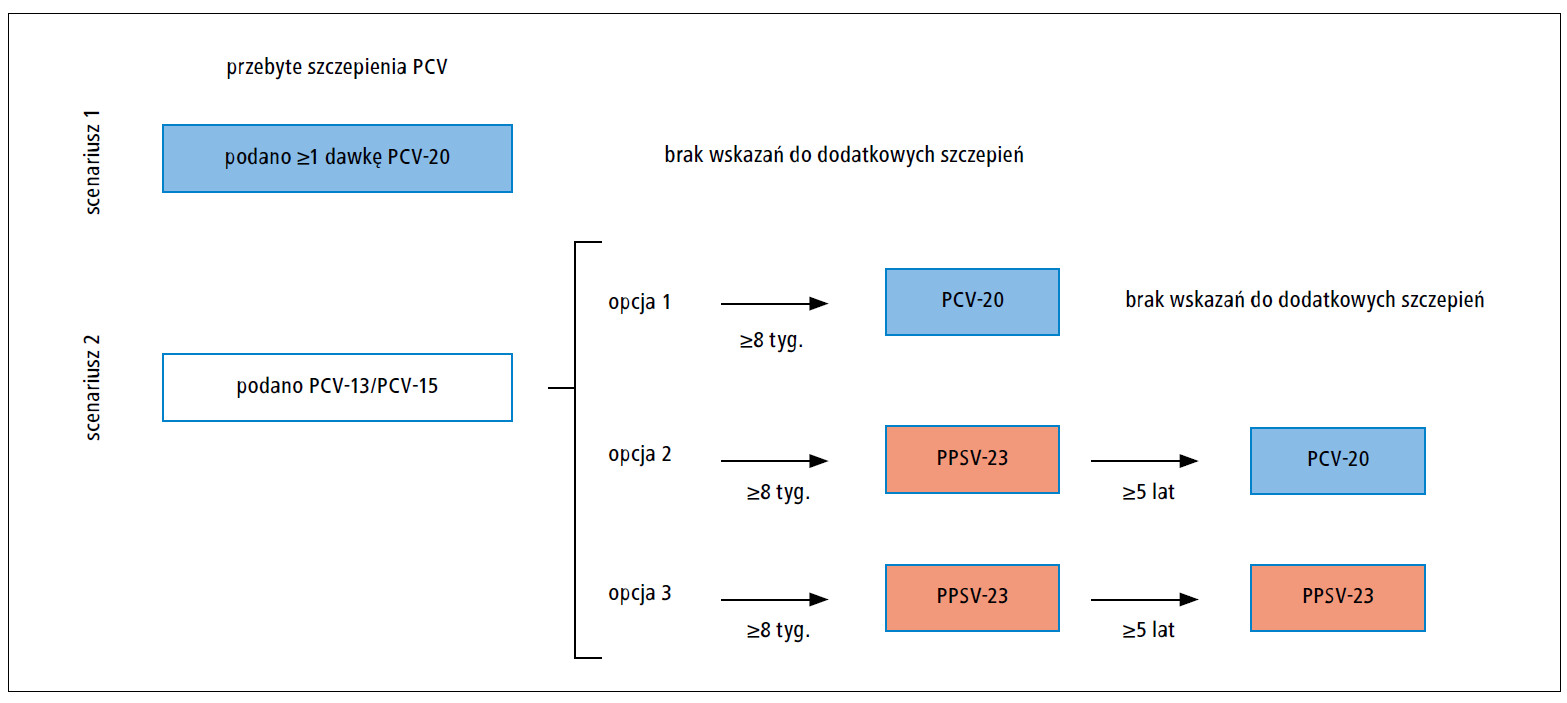
Ryc. 2. Zalecane szczepienia przeciwko pneumokokom u osób w wieku 2–18 lat z niedoborem odporności (zespół nerczycowy, leczenie nerkozastępcze, asplenia wrodzona lub nabyta, lub zaburzenia funkcji śledziony, wrodzone lub nabyte niedobory odporności, choroby wymagające leczenia immunosupresyjnego lub radioterapii, w tym nowotwory złośliwe, białaczki, chłoniaki, choroba Hodgkina, przeszczepienie narządu miąższowego, zakażenie HIV, niedokrwistość sierpowatokrwinkowa lub inne hemoglobinopatie), które otrzymały wszystkie zalecane dawki PCV przed ukończeniem 6 lat.
PCV – skoniugowana szczepionka przeciwko pneumokokom, PCV-13 – 13-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-15 – 15-walentna skoniugowana szczepionka przeciwko pneumokokom, PCV-20 – 20-walentna skoniugowana szczepionka przeciwko pneumokokom, PPSV-23 – 23-walentna polisacharydowa szczepionka przeciwko pneumokokom
Nieszczepione dzieci w wieku 2–23 miesięcy
Wszystkie dzieci w wieku 2–23 miesięcy, które wcześniej nie były szczepione skoniugowaną szczepionką przeciwko pneumokokom (PCV), powinny otrzymać PCV-15 lub PCV-20 w aktualnie zalecanym schemacie (p. tab. 1 i 2).
Dzieci w wieku 24–71 miesięcy z niepełnym szczepieniem PCV
Dzieciom w wieku 24–59 miesięcy bez dodatkowych obciążeń zdrowotnych, które nie otrzymały pełnego schematu szczepienia PCV, należy podać 1 dawkę PCV-15 lub PCV-20. Nie zaleca się rutynowego szczepienia PCV zdrowych dzieci w wieku ≥5 lat (p. tab. 1 i 2).
Dzieciom w wieku 24–71 miesięcy z ≥1 czynnikiem ryzyka inwazyjnej choroby pneumokokowej (IChP [p. ramka i tab. 3]), które przed ukończeniem 24. miesiąca życia otrzymały <3 dawki PCV, należy podać 2 dawki PCV-15 lub 2 dawki PCV-20 w odstępie ≥8 tygodni.
Dzieciom w wieku 24–71 miesięcy z ≥1 czynnikiem ryzyka IChP (p. ramka i tab. 3), które przed ukończeniem 12. miesiąca życia otrzymały 3 dawki PCV, należy podać 1 dawkę PCV-15 lub PCV-20 w odstępie ≥8 tygodni od ostatniego szczepienia PCV.
Ramka. Czynniki ryzyka inwazyjnej choroby pneumokokowej u dzieci
- wyciek płynu mózgowo-rdzeniowego
- przewlekła choroba serca
- przewlekła choroba nerek
- przewlekła choroba wątroby
- przewlekła choroba płuc (w tym astma w stopniu umiarkowanym i ciężkim)
- implant ślimakowy
- cukrzyca
- asplenia wrodzona, nabyta lub zaburzenia funkcji śledziony
- pierwotny lub wtórny niedobór odporności
- choroby wymagające leczenia immunosupresyjnego lub radioterapii, w tym nowotwory złośliwe, białaczki, chłoniaki, choroba Hodgkina, przeszczepienie narządu miąższowego
- zakażenie HIV
- niedokrwistość sierpowatokrwinkowa lub inne hemoglobinopatie
Dzieci w wieku 2–18 lat z ≥1 czynnikiem ryzyka IChP, które otrzymały pełne szczepienie PCV przed ukończeniem 6. roku życia
Dzieci, które otrzymały ≥1 dawkę PCV-20, nie wymagają dodatkowego szczepienia przeciwko pneumokokom.
Dzieci, które nie otrzymały ≥1 dawki PCV-20 przed ukończeniem 6. roku życia, powinny otrzymać 1 dawkę PCV-20 lub ≥1 dawkę 23-walentnej polisacharydowej szczepionki przeciwko pneumokokom (PPSV-23) po upływie ≥8 tygodni od ostatniego szczepienia PCV (p. tab. 3 i ryc. 1). Dzieciom z niedoborem odporności, zaszczepionym PPSV-23 zamiast PCV-20, po upływie ≥5 lat należy podać 1 dawkę PCV-20 lub drugą dawkę PPSV-23 (p. ryc. 2).
Dzieci w wieku 6–18 lat z ≥1 czynnikiem ryzyka IChP, które nie były szczepione PCV-13, PCV-15 lub PCV-20
≥8 tygodni po ostatnim szczepieniu przeciwko pneumokokom, niezależnie od tego, czy podano PPSV-23, czy PCV-7, zaleca się podać 1 dawkę PCV-15 lub PCV-20. Wybierając PCV-15, należy dodatkowo podać PPSV-23 po upływie ≥8 tygodni od ostatniego szczepienia PCV, jeżeli dziecko nie otrzymało wcześniej szczepionki polisacharydowej. Wybierając PCV-20, dodatkowe szczepienie PPSV-23 nie jest konieczne.
Zalecenia Centers for Disease Control and Prevention (CDC)
Zalecenia CDC mają ułatwić realizację szczepień zgodnie z nowymi wytycznymi ACIP.
Stosowanie PCV-13 w przypadku niedostępności PCV-15 i PCV-20
Jeżeli zgodnie z obowiązującym programem szczepień dziecko powinno otrzymać PCV, a PCV-15 i PCV-20 nie są dostępne, szczepienie można zrealizować z użyciem PCV-13 (wg polskiego PSO PCV-10 – przyp. red.) według wcześniej obowiązujących zaleceń.
Kontynuacja szczepień rozpoczętych PCV-13
Szczepienia przeciwko pneumokokom nie trzeba rozpoczynać od nowa, można je kontynuować z użyciem PCV-15 lub PCV-20.
Zdrowe dzieci w wieku 24–59 miesięcy z pełnym szczepieniem PCV-13
Nie jest wskazane podawanie dodatkowej dawki PCV-15 lub PCV-20.
Dzieci w wieku 6–18 lat z grupy ryzyka IChP, zaszczepione PCV-13 w wieku ≥6 lat
Zaleca się podać 1 dawkę PCV-20 lub ≥1 dawkę PPSV-23 po upływie ≥8 tygodni od ostatniego szczepienia PCV-13. U dzieci z niedoborem odporności w przypadku wyboru PPSV-23, po upływie ≥5 lat należy podać 1 dawkę PCV-20 lub drugą dawkę PPSV-23.
Dzieci po przeszczepieniu macierzystych komórek krwiotwórczych (HSCT)
Dzieciom po HSCT zaleca się podać 3 dawki PCV-20 w odstępie 4 tygodni. Szczepienie należy rozpocząć 3–6 miesięcy po HSCT, a ≥6 miesięcy po podaniu trzeciej dawki PCV-20 lub ≥12 miesięcy po HSCT, w zależności od tego, co nastąpi później, należy podać czwartą dawkę PCV-20. Jeżeli biorca HSCT rozpoczął już szczepienie z użyciem PCV-13 lub PCV-15, 4-dawkowy schemat można kontynuować PCV-20, bez rozpoczynania szczepienia od nowa.
Jeżeli PCV-20 nie jest dostępna, można podać 3 dawki PCV-15, a następnie 1 dawkę PPSV-23 ≥12 miesięcy po HSCT. Osobom z przewlekłą chorobą przeszczep przeciwko gospodarzowi (GvHD) zamiast PPSV-23 należy podać czwartą dawkę PCV-15, ponieważ szansa na uzyskanie odpowiedzi na szczepienie PPSV-23 jest mała. Optymalny czas na wykonanie szczepienia może wyznaczyć zespół transplantacyjny, który posiada najwięcej informacji o pacjencie.
Podawanie szczepionek
PCV można podawać na tej samej wizycie co inne szczepionki rutynowo stosowane u dzieci, w tym również przeciwko COVID-19, w oddzielnych strzykawkach i w różne okolice anatomiczne ciała. W badaniach oceniono równoczesne podawanie PCV-20 oraz szczepionek przeciwko błonicy, tężcowi, krztuścowi (bezkomórkowych), polio (inaktywowanych), Haemophilius influenzae typu b (Hib), wirusowemu zapaleniu wątroby typu B, odrze, śwince, różyczce, rotawirusom i ospie wietrznej. Immunogenność tych szczepionek w grupach zaszczepionych PCV-20 lub PCV-13 była podobna. Nie przeprowadzono badań oceniających koadministrację PCV-20 ze szczepionkami przeciwko meningokokom. W przypadku preparatu Menactra (szczepionki przeciwko meningokokom grupy A, C, W, Y sprzężonej z toksoidem błonicy) zaleca się zachować takie same środki ostrożności jak przy PCV-13 (preparat Menactra zaleca się podać ≥4 tyg. po ukończeniu schematu szczepienia PCV-13 – przyp. red.). U dzieci, które otrzymały PCV-20 równocześnie ze szczepionką przeciwko grypie (10–20% dzieci uczestniczących w badaniach klinicznych), nie odnotowano drgawek gorączkowych (Pfizer, dane niepublikowane).
Uzasadnienie nowych zaleceń
Włączenie PCV-20 do zalecanych schematów szczepienia dzieci przeciwko pneumokokom może zapewnić ochronę przed zakażeniami typami serologicznymi uwzględnionymi wyłącznie w składzie PCV-20 i zmniejszyć zapadalność na IChP, zapalenie płuc i OZUŚ (p. punkt dotyczący epidemiologii choroby pneumokokowej). W ocenie immunogenności w badaniach z randomizacją stężenie przeciwciał swoistych dla serotypów wspólnych dla PCV-13 i PCV-20 było mniejsze u dzieci zaszczepionych PCV-20, jednak znaczenie kliniczne tego zjawiska jest nieznane. Bezpieczeństwo PCV-20 nie różniło się od PCV-13. Nie przeprowadzono badań bezpośrednio porównujących PCV-20 z PCV-15 pod kątem immunogenności i bezpieczeństwa. Nie oceniono również immunogenności PCV-20 u dzieci z grupy ryzyka IChP. Ograniczone dane na temat skuteczności rzeczywistej PCV-13 pochodzące z badań obserwacyjnych obejmujących dzieci z chorobami przewlekłymi wykazały, że PCV-13 zapewnia ochronę przed IChP i zapaleniem płuc wywołanymi przez serotypy uwzględnione w składzie tej szczepionki.
We wcześniejszej wersji wytycznych dzieciom i młodzieży w wieku 6–18 lat obarczonymi czynnikami ryzyka innymi niż niedobór odporności, wyciek płynu mózgowo-rdzeniowego i wszczepiony implant ślimakowy, które nie były szczepione PCV, zalecano podanie wyłącznie 1 dawki PPSV-23 (nie zalecano uzupełnienia szczepienia PCV). W 1 badaniu wykazano jednak, że mimo dużego odsetka populacji USA zaszczepionej przeciwko pneumokokom, dzieci w wieku 5–17 lat z takimi czynnikami ryzyka (np. astmą, przewlekłą chorobą serca, wątroby, płuc, cukrzycą) był narażone na 2–10 razy większe ryzyko IChP i 3–7 razy większe ryzyko pneumokokowego zapalenia płuc niż dzieci bez takich obciążeń. Oczekuje się, że podanie PCV zapewni dodatkową ochronę tej grupie wiekowej, narażonej na większe ryzyko choroby pneumokokowej. Poza tym nowe wytyczne ujednolicają zalecenia dla różnych grup ryzyka, w tym również dla dorosłych w wieku 19–64 lat.
Zastosowanie PCV-20 w grupach ryzyka może być efektywniejsze kosztowo niż szczepienie w schemacie PCV-13/PCV-15 i PPSV-23.
Epidemiologia choroby pneumokokowej u osób w wieku <19 lat
W latach 2018–2019 w USA zapadalność na IChP wyniosła 7,2/100 000 dzieci w wieku <5 lat i 1,5/100 000 dzieci w wieku 5–18 lat. W grupie wiekowej <5 lat typy serologiczne pneumokoka uwzględnione w składzie PCV-13 odpowiadały za 21% przypadków IChP, a typy uwzględnione wyłącznie w składzie szczepionki 20-walentnej (PCV-20) – za 32% przypadków IChP. W grupie wiekowej 5–18 lat odsetki te wyniosły odpowiednio 34% i 29%.
Według danych z systemu nadzoru CDC Active Bacterial Core ogólny wskaźnik zapadalności na IChP u dzieci w 2020 roku, w porównaniu z latami 2018–2019, zmniejszył się o >50%. Mogło to mieć związek ze stosowaniem środków zapobiegających transmisji SARS-CoV-2, takich jak noszenie masek i zachowanie dystansu społecznego. Zapadalność na IChP u dzieci w wieku <5 lat była większa w 2021 roku niż w 2020 roku (lecz mniejsza niż przed pandemią), natomiast nie zmieniła się w grupie wiekowej 5–18 lat. Wstępne dane z 2022 roku wskazują, że w obu powyższych grupach wiekowych zapadalność na IChP w listopadzie i grudniu przewyższyła o ≥50% zapadalność w latach 2018–2019.
Szacuje się, że przed pandemią COVID-19 częstość wizyt ambulatoryjnych z powodu zapalenia płuc wywołanego przez serotyp szczepionkowy wyniosła 5,5/1000 osobolat (11,5 i 0,3/1000 osobolat odpowiednio w grupach wiekowych <2 lat i 2–4 lat). Częstość wizyt z powodu zakażeń serotypami uwzględnionymi w PCV-20, których nie ma w składzie PCV-13, oszacowano na 0,6–0,9/1000 osobolat w przypadku zapalenia płuc i 5,4–7,4/1000 osobolat w przypadku OZUŚ. W badaniu z prospektywnym zbieraniem danych w latach 2015–2019 za 24% zachorowań na OZUŚ u dzieci w wieku <3 lat odpowiadał S. pneumoniae. Spośród zakażeń pneumokokowych 28% stanowiły zakażenia typem uwzględnionym w składzie PCV-20, a niezawartym w PCV-13.
Dzieci z grupy ryzyka
Dane na temat epidemiologii choroby pneumokokowej u dzieci z chorobami przewlekłymi i innymi czynnikami ryzyka są ograniczone. Według danych z lat 2007–2010 ryzyko IChP u dzieci w wieku <5 lat z niedoborem odporności lub implantem ślimakowym było 11,2 razy większe niż u dzieci w tym samym wieku bez dodatkowych obciążeń. W przypadku pneumokokowego zapalenia płuc ryzyko było prawie 7 razy większe. U dzieci i młodzieży w wieku 5–17 lat odnotowano odpowiednio 40- i 10-krotne zwiększenie ryzyka.
Zwiększone ryzyko choroby pneumokokowej obserwowano też u dzieci z chorobami przewlekłymi, które według wcześniejszych zaleceń nie stanowiły czynnika ryzyka IChP. Dzieci chore na astmę, które nie stosowały doustnych glikokortykosteroidów, były narażone na 1,8–2,2 razy większe ryzyko pneumokokowego zapalenia płuc niż dzieci bez dodatkowych obciążeń. Według innego badania obejmującego dzieci i dorosłych w wieku 2–49 lat astma była niezależnym czynnikiem ryzyka IChP (skorygowany iloraz szans: 2,4). Ryzyko IChP u dzieci w wieku 3–59 miesięcy z przewlekłą chorobą nerek (niewymagającą dializy) było 3,6 razy większe niż w grupie kontrolnej. Przewlekła choroba wątroby wiązała się z 18,5-krotnym zwiększeniem ryzyka IChP u dzieci w wieku <5 lat i około 7–8-krotnym zwiększeniem ryzyka pneumokokowego zapalenia płuc u dzieci w wieku <18 lat.
Immunogenność PCV-20
W badaniach z randomizacją porównano immunogenność PCV-20 podanej w 4-dawkowym schemacie zdrowym dzieciom w wieku <2 lat z immunogennością PCV-13 (schemat 3+1, wiek 2, 4, 6, 12–15 mies.). 30 dni po podaniu trzeciej i czwartej dawki oceniono średnią geometryczną stężenia (GMC) serotypowo swoistych przeciwciał w klasie IgG oraz miano przeciwciał w teście opsonofagocytozy (OPA). W badaniach II fazy w grupie PCV-20 stwierdzono mniejsze GMC przeciwciał IgG swoistych dla 13 wspólnych serotypów i większe GMC przeciwciał swoistych dla 7 serotypów uwzględnionych wyłącznie w składzie PCV-20. W badaniu III fazy PCV-20 spełniła kryteria nie gorszej odpowiedzi dla 8 z 13 serotypów zawartych w PCV-13 i PCV-20 oraz dla 6 z 7 serotypów uwzględnionych wyłącznie w składzie PCV-20, mierzonej jako odsetek uczestników, którzy po podaniu trzeciej dawki wytworzyli przeciwciała IgG w stężeniu powyżej przyjętej wcześniej wartości. Natomiast w pomiarze GMC swoistych przeciwciał IgG po podaniu trzeciej i czwartej dawki PCV-20 spełniła kryteria nie gorszej odpowiedzi dla wszystkich wspólnych 13 serotypów i 7 serotypów uwzględnionych wyłącznie w PCV-20. Po podaniu czwartej dawki średnia geometryczna miana (GMT) swoistych przeciwciał w teście OPA dla serotypów wspólnych dla PCV-13 i PCV-20 była podobna, z wyjątkiem typów 1 i 3, dla których odnotowano mniejszą GMT w grupie PCV-20.
U zdrowych dzieci w wieku od 15 miesięcy do 17 lat (wszystkie dzieci w wieku <5 lat miały udokumentowane szczepienie ≥3 dawkami PCV-13) miesiąc po podaniu 1 dawki PCV-20 GMC serotypowo swoistych przeciwciał było większe niż przed szczepieniem dla 13 wspólnych serotypów i 7 serotypów uwzględnionych wyłącznie w składzie PCV-20. Również w teście OPA GMT przeciwciał dla wszystkich 20 serotypów było większe po podaniu 1 dawki PCV-20 niż przed podaniem tej szczepionki.
Nie oceniono immunogenności PCV-20 u dzieci z grupy ryzyka IChP.
Bezpieczeństwo PCV-20
Bezpieczeństwo PCV-20 oceniono w 4 badaniach klinicznych: w 3 uczestniczyło 3949 zdrowych dzieci w wieku <2 lat (2232 otrzymało PCV-20, a 1717 PCV-13), a w 1 badaniu 831 zdrowych dzieci w wieku od 15 miesięcy do 17 lat. U niemowląt częstość objawów miejscowych (takich jak zaczerwienienie, obrzęk i ból w miejscu wkłucia) w ciągu 7 dni obserwacji była podobna po podaniu każdej dawki PCV-20 i PCV-13 (odpowiednio: 44,8–59,8% i 45,9–56,5%). W przypadku reakcji systemowych (np. gorączka, zmniejszone łaknienie, niepokój, senność) odsetki te wyniosły odpowiednio: 35,1–40,7% i 33,8–41,0%. W zdecydowanej większości przypadków reakcje miały charakter łagodny lub umiarkowany. Miejscowe i uogólnione reakcje o ciężkim przebiegu odnotowano odpowiednio u ≤0,4 i ≤4,5% dzieci. Ciężkie zdarzenia niepożądane w okresie ≤6 miesięcy od podania czwartej dawki zarejestrowano u 4,5% dzieci do 2. roku życia z grupy PCV-20 i 3,7% dzieci z grupy PCV-13. Nie zaobserwowano różnic między grupami, które mogłyby wskazywać na związek przyczynowy zdarzenia niepożądanego z podaniem PCV-20. Nie odnotowano żadnego zgonu. W grupie wiekowej od 15 miesięcy do 18 lat (831 osób) w okresie ≤6 miesięcy po podaniu PCV-20 wystąpiło 5 ciężkich zdarzeń niepożądanych. Nie zgłoszono żadnego zgonu. Drgawki gorączkowe odnotowano u 7 (0,2%) dzieci z grupy PCV-20 i 2 (0,1%) dzieci z grupy PCV-13 uczestniczących we wszystkich 4 powyższych badaniach. Uznano, że 2 przypadki drgawek gorączkowych mogą mieć związek z PCV-20: u 1 dziecka drgawki wystąpiły 14 dni po podaniu na tej samej wizycie czwartej dawki PCV-20 i MMR, a u innego dziecka 7 dni po szczepieniu czwartą dawką rozpoznano też COVID-19. Wszystkie pozostałe epizody drgawek gorączkowych wystąpiły >30 dni po szczepieniu.
(W oryginale 29 pozycji piśmiennictwa.)
















