Wstęp
W ostatnich latach coraz większą uwagę zwraca się na możliwość zapobiegania wielu chorobom przewlekłym, takim jak nadwaga, otyłość czy choroby układu sercowo-naczyniowego, już w okresie przedkoncepcyjnym, prenatalnym czy w pierwszych latach życia. Podstawą takich założeń stała się koncepcja programowania metabolicznego.
Hipoteza programowania metabolicznego
Definicja
Termin „programowanie metaboliczne” oznacza, że czynniki środowiskowe (w tym żywieniowe) działające w określonym okresie życia – tzw. krytycznym okresie wczesnego rozwoju (m.in. w okresie przedkoncepcyjnym, prenatalnym i w ciągu kilku pierwszych lat życia) – powodują trwałe zmiany metabolizmu ustrojowego z odległymi konsekwencjami zdrowotnymi i rozwojowymi. Popularnym określeniem tego okresu jest hasło „pierwsze 1000 dni życia”.
Geneza
Pierwsze obserwacje dotyczące wpływu wczesnej ekspozycji na niekorzystne czynniki środowiskowe na zdrowie w późniejszych okresach życia pochodzą z pierwszej połowy XX w. Kluczową rolę w rozwoju teorii programowania (w języku angielskim określanej często terminem developmental origins of health and disease – DOHaD) odegrały jednak doniesienia zespołu brytyjskiego epidemiologa Davida Barkera. Tłumacząc prenatalne programowanie chorób układu sercowo-naczyniowego, zwracał on uwagę na zaburzenia odżywienia płodu prowadzące do „stresu płodowego”, zaburzeń metabolizmu glikokortykosteroidów w łożysku i w konsekwencji do wewnątrzmacicznego zahamowania wzrastania (dawniej: dystrofia wewnątrzmaciczna). Zgodnie z założeniami teorii Barkera, mechanizm rozwoju chorób układu sercowo-naczyniowego lub otyłości u tych osób wiąże się z zaprogramowaniem do preferencyjnego odkładania tkanki tłuszczowej, zwłaszcza w przypadku nadmiernego spożycia energii w kolejnych latach życia. Niedożywienie płodu (fetal undernutirion hypothesis) jest tylko jedną z możliwych przyczyn tych chorób. Dzieci matek z otyłością w okresie płodowym narażone są na nadmierną ilość składników pokarmowych (fetal overnutrition hypothesis), co w konsekwencji prowadzi do zmian metabolizmu, zaburzeń kontroli uczucia głodu i sytości oraz działania układu hormonalnego. Tym samym potomstwo matek z otyłością obarczone jest zwiększonym ryzykiem rozwoju otyłości, chorób układu sercowo-naczyniowego i innych zaburzeń. Hipoteza Barkera została obecnie uzupełniona o działanie czynników środowiskowych w okresie postnatalnym (postnatal accelerated weight gain hypothesis). Zgodnie z nią na zwiększone ryzyko rozwoju otyłości i zespołu metabolicznego w późniejszym okresie życia wpływa zbyt szybkie zwiększenie masy ciała w okresie niemowlęcym (jako skutek nieprawidłowego żywienia). Różne hipotezy tłumaczące efekt programowania otyłości oraz chorób związanych z otyłością przedstawiono schematycznie na rycinie.
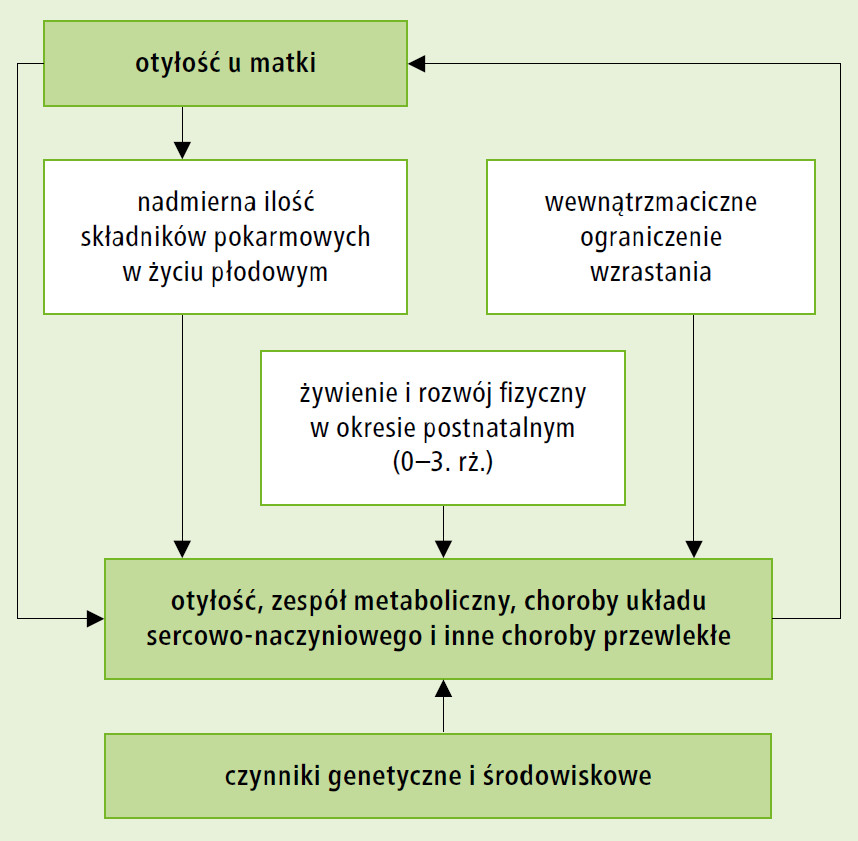
Ryc. Hipotezy wyjaśniające efekt programowania otyłości oraz
chorób związanych z otyłością
Potencjalne mechanizmy
W ostatnich latach duża liczba badań naukowych (zwłaszcza z zakresu epigenetyki) koncentruje się na wyjaśnieniu mechanizmów programowania metabolicznego. Efekt programowania tłumaczy się między innymi zmianami:
- strukturalnymi w narządach i tkankach (np. mniejszą liczbą nefronów z następczym ryzykiem rozwoju nadciśnienia tętniczego oraz zmianami w tkance tłuszczowej i mięśniowej prowadzącymi do insulinooporności);
- hormonalnymi (ekspozycja na nadmiar glikokortykosteroidów w okresie płodowym i związany z tym wpływ na układ renina–angiotensyna–aldosteron oraz homeostazę glukozy, zmiany w obrębie mózgu, zwłaszcza podwzgórza, wpływające na mechanizmy kontroli apetytu, wpływ na rozwój osi podwzgórze–przysadka–nadnercza);
- epigenetycznymi, czyli dotyczącymi ekspresji genów bez zmian w sekwencji DNA (np. metylacja DNA, regulacja niekodującego RNA), które mogą ulegać utrwaleniu i poprzez gamety są przekazywane następnym pokoleniom.
Żywienie we wczesnym okresie życia a ryzyko wybranych chorób cywilizacyjnych
Okres okołokoncepcyjny i prenatalny
Liczne badania z zakresu nauk podstawowych oraz epidemiologiczne wskazują na silny związek pomiędzy stanem zdrowia kobiety w okresie przedkoncepcyjnym oraz w czasie ciąży a późniejszym ryzykiem rozwoju chorób przewlekłych u jej potomstwa. W świetle najnowszych danych naukowych szczególnie okres okołokoncepcyjny uznaje się za kluczowy dla kształtowania zdrowia przyszłych pokoleń. Autorzy serii artykułów poświęconych zdrowiu w okresie poprzedzającym ciążę, opublikowanych w 2018 r. na łamach czasopisma „The Lancet”, zwracają uwagę na istotny wpływ czynników środowiskowych (takich jak jakość diety przyszłych rodziców – zarówno matki, jak i ojca) na dojrzewające gamety i zarodek. W tym kontekście podkreśla się fakt, że duży odsetek kobiet w wieku prokreacyjnym – zarówno w krajach rozwiniętych, jak i rozwijających się – stosuje nieoptymalną dietę, prowadzącą do zaburzeń stanu odżywienia, takich jak nadwaga i otyłość, niedożywienie czy niedobór mikroskładników. Metaanaliza indywidulnych danych 162 129 par matka–dziecko pochodzących z 37 kohort z Europy, Ameryki Północnej i Australii wykazała (uwzględniając poprawkę na liczne czynniki zakłócające), że większa wartość BMI matki w okresie poprzedzającym ciążę wiąże się ze zwiększonym ryzykiem wystąpienia nadwagi i otyłości u potomstwa we wczesnym i późnym dzieciństwie. Związek ten można wytłumaczyć (przynajmniej częściowo) mechanizmami programowania metabolicznego. Dlatego też optymalizacja zaspokojenia zapotrzebowania energetycznego i normalizacja masy ciała u kobiet w wieku prokreacyjnym wydaje się jedną z istotnych strategii zapobiegania otyłości u potomstwa. Na podstawie dostępnych danych naukowych eksperci dodatkowo zwracają uwagę na jakość diety oraz istotną rolę suplementacji kwasu foliowego, odpowiedniej dawki witaminy D, żelaza, jodu i wapnia u kobiet przed ciążą i podczas niej. Liczne badania epidemiologiczne skupiają się również na innych aspektach diety matki (np. spożyciu wielonienasyconych kwasów tłuszczowych czy ultraprzetworzonej żywności) w odniesieniu do długoterminowych zdrowotnych punktów końcowych. Na podstawie dotychczasowych badań (głównie obserwacyjnych) sugeruje się, że masa ciała kobiety oraz żywienie w okresie poprzedzającym ciążę i podczas ciąży, poza wpływem na krótkoterminowe punkty końcowe (głównie ciążowe i okołoporodowe), związane są m.in. z ryzykiem rozwoju otyłości, chorób sercowo-naczyniowych, metabolicznych, alergicznych czy psychicznych w dalszym okresie życia dziecka.
Pomimo obiecujących wyników badań obserwacyjnych badania z randomizacją oceniające efekty optymalizacji diety kobiet w okresie ciąży wykazują względnie niewielki efekt w odniesieniu do krótko- i długoterminowych punktów końcowych. Autorzy przeglądów oceniających skuteczność takich interwencji zwracają uwagę, że badania z randomizacją przeprowadzane są na ogół z udziałem kobiet w drugiej połowie ciąży i nie obejmują okresu okołokoncepcyjnego oraz wczesnej ciąży. Koncentrują się głównie na pojedynczych aspektach zdrowego stylu życia czy nawet diety, podczas gdy największe szanse na istotne efekty zdrowotne mają interwencje złożone. Dodatkowe problemy w badaniach interwencyjnych to niski stopień przestrzegania zaleceń w ramach stosowanej interwencji, zbyt krótki czas interwencji i obserwacji, selektywny dobór badanej populacji (często grupy dużego ryzyka) czy grupa kontrolna, która ze względów etycznych nie może być grupą stosującą mniej zdrową dietę. Nie zmienia to jednak faktu, że postulowany przyczynowo-skutkowy charakter wielu opisanych wyżej związków (asocjacji) zaobserwowanych w badaniach obserwacyjnych wciąż oczekuje na weryfikację w odpowiednio zaplanowanych badaniach z randomizacją.
Okres niemowlęcy
Karmienie piersią
Aktualne (2022 r., 2019 r., 2015 r.) systematyczne przeglądy piśmiennictwa podsumowują wpływ karmienia piersią na krótko- i długoterminowe efekty zdrowotne związane z programowaniem żywieniowym. Oceniają między innymi związek karmienia piersią z otyłością (2022 r.), cukrzycą (2019 r.) oraz parametrami lipidowymi i ciśnieniem tętniczym (2015 r.). Autorzy zaobserwowali ochronny wpływ karmienia piersią na ryzyko rozwoju otyłości (2022 r.) i cukrzycy typu 2 (2019 r.). Po uwzględnieniu w analizie znanych czynników zakłócających efekt ten uległ zmniejszeniu, ale nie został zniwelowany. Nie zaobserwowano natomiast związku karmienia piersią z obniżeniem ciśnienia tętniczego czy z parametrami metabolizmu lipidów (2015 r.). We wcześniejszym przeglądzie systematycznym ograniczonym jedynie do wpływu karmienia piersią na rozwój intelektualny dzieci zaprezentowano spójne dane: lepsze wyniki w testach oceniających iloraz inteligencji (IQ) średnio o ~3 punkty (2015 r.). Głównym ograniczeniem tych badań jest ich obserwacyjny charakter. Wyniki interwencyjnego badania z randomizacją przeprowadzonego na Białorusi (PROBIT), w którym u części kobiet prowadzono aktywną promocję karmienia piersią, uzyskując zarówno dłuższy czas karmienia, jak i większy odsetek matek karmiących wyłącznie piersią, potwierdziły korzystny wpływ na rozwój mowy u dzieci, który w odległej obserwacji utrzymywał się także w wieku 16 lat. W grupie poddanej interwencji nie zaobserwowano jednak różnic w wartościach ciśnienia tętniczego czy korzystnych efektów w odniesieniu do częstości nadwagi i otyłości w porównaniu z grupą kontrolną.
Białko
Białko w diecie niemowląt i małych dzieci jest niezbędne do prawidłowego rozwoju, jednak w ostatnich latach zwrócono uwagę na niekorzystne skutki spożywania nadmiernej jego ilości we wczesnym okresie życia. Postuluje się, że białko w ilości przekraczającej zapotrzebowanie stymuluje wydzielanie insuliny oraz IGF-1, co wpływa na nadmierne zwiększenie masy ciała w okresie niemowlęcym, a w konsekwencji wiąże się ze zwiększonym ryzykiem otyłości. Zawartość białka w różnych preparatach mleka modyfikowanego powszechnie dostępnych na rynku istotnie przewyższa ilość zawartą w mleku kobiecym, stąd próby oceny w kolejnych badaniach preparatów o zmniejszonej zawartości białka. W opublikowanym w 2016 r. przeglądzie systematycznym badań z randomizacją oceniono wpływ różnej (ilościowo) zawartości białka w mleku modyfikowanym dla niemowląt w 1. roku życia na ich rozwój fizyczny, zawartość tkanki tłuszczowej oraz ryzyko nadwagi i otyłości w późniejszym okresie. Poza przemijającym wpływem na średnią długość niemowląt w 3. miesiącu życia nie obserwowano różnic pomiędzy grupami w odniesieniu do przyrostu długości. Dzieci karmione mlekiem o mniejszej zawartości białka osiągały mniejszą masę ciała jedynie pomiędzy 6. a 12. miesiącem życia. Jedyne badanie z randomizacją (badanie CHOP [Childhood Obesity Programme]) oceniające BMI w drugim półroczu życia (jeszcze w czasie interwencji) i w okresie późniejszym (24. mż., 6. rż.) potwierdziło mniejszą wartość BMI i mniejsze ryzyko rozwoju otyłości u dzieci karmionych mlekiem modyfikowanym o zredukowanej zawartości białka. Badanie CHOP wykazało także większą zawartość tłuszczu wokółotrzewnowego przy niezmienionej ilości tłuszczu podskórnego u dzieci w wieku 5 lat, które otrzymywały większą ilość białka w okresie niemowlęcym.
W projekcie CHOP podjęto również próbę wyjaśnienia mechanizmu programowania metabolicznego otyłości. Zwiększone spożycie białka w wieku 6 miesięcy prowadziło do zwiększenia stężenia aminokwasów rozgałęzionych w surowicy oraz stymulacji osi IGF-1, co przemawia za szczególną rolą IGF-1 w programowaniu metabolicznym otyłości. Jednocześnie postuluje się, że białko w ilości przekraczającej zapotrzebowanie stymuluje wydzielanie insuliny, za czym przemawia zwiększone stężenie peptydu C i wartość wskaźnika peptyd C/kreatynina w moczu. Nadal trudno określić zakres wieku, w którym białko może wywierać wpływ programujący na ryzyko otyłości.
Obecnie (styczeń 2023 r.) prowadzone jest badanie z randomizacją oceniające efekty różnej zawartości białka w mleku modyfikowanym u dzieci w 2. roku życia. We wcześniejszym badaniu z randomizacją porównującym mleko modyfikowane typu „Junior” o zmniejszonej zawartości białka z mlekiem krowim u dzieci w 2. roku życia wykazano mniejszą ilość tkanki tłuszczowej w grupie otrzymującej mleko modyfikowane w wieku 2 lat. W przeglądzie systematycznym badań z randomizacją oraz kohortowych z prospektywnym zbieraniem danych (2022 r.) oceniano wpływ ilości białka w pełnej diecie zdrowych niemowląt i dzieci (od 4. mż. do 5. rż.) na ich rozwój fizyczny, BMI i zawartość tkanki tłuszczowej. Wykazano w nim, że większe spożycie białka u dzieci ≤18. miesiąca życia wiąże się z większym BMI (zwłaszcza w przypadku spożywania białka pochodzenia zwierzęcego) oraz większym ryzykiem nadwagi i otyłości w późniejszym dzieciństwie. Wydaje się ponadto, że korzystnie wpływa na zawartość tkanki tłuszczowej.
Podsumowując: w obu przeglądach dane pochodzące z badań eksperymentalnych są ograniczone. Wydaje się jednak, że zmniejszenie spożycia białka (zwłaszcza pochodzenia zwierzęcego) we wczesnym okresie życia może korzystnie wpłynąć na późniejsze ryzyko nadwagi i otyłości. Potwierdzenie tego efektu wymaga kolejnych dobrze zaplanowanych, wysokiej jakości badań z randomizacją.
Tłuszcze i cukry
W przeglądzie systematycznym piśmiennictwa oceniającym wpływ żywienia niemowląt i małych dzieci na późniejsze ryzyko nadwagi i otyłości oraz zawartość tkanki tłuszczowej (2016 r., aktualizacja w 2020 r.) autorzy podkreślili brak jednoznacznych dowodów na związek między spożyciem wielonienasyconych kwasów tłuszczowych (PUFA) we wczesnym dzieciństwie (w tym jako dodatek do mleka modyfikowanego dla niemowląt) a wyżej wymienionymi punktami końcowymi. Wyniki badań dotyczących wpływu spożycia napojów słodzonych we wczesnym okresie życia na BMI podsumowano jako sprzeczne. Na podstawie ograniczonych danych naukowych stwierdzono natomiast, że podawanie napojów słodzonych w okresie wprowadzania pokarmów uzupełniających oraz większa ilość cukru w diecie mogą się wiązać ze zwiększonym ryzykiem nadwagi u dzieci. Wyniki te potwierdza także jeden z serii przeglądów systematycznych badań interwencyjnych i obserwacyjnych (2019 r., „The Pregnancy and Birth to 24 Months Project”) przeprowadzonych na potrzeby opracowania amerykańskich wytycznych żywieniowych.
Programowanie mikrobiotyczne
W procesy programowania zdrowia włączone są nie tylko mechanizmy metaboliczne organizmu, ale prawdopodobnie bierze w nich udział również mikrobiota. Podlega ona dynamicznym zmianom w niemowlęctwie i jest kształtowana przez różne czynniki zewnętrzne, takie jak sposób żywienia (np. karmienie piersią vs mlekiem modyfikowanym) czy rodzaj porodu (drogami natury vs cięcie cesarskie). Przykładem programowania mikrobiotycznego może być kształtowanie ryzyka otyłości wśród dzieci w wieku szkolnym zależnie od składu mikrobioty jelitowej w okresie niemowlęcym. W jednym z badań zaobserwowano bowiem mniejsze ryzyko rozwoju otyłości u dzieci 7-letnich, u których w analizie stolca w 1. roku życia stwierdzono większą liczbę bakterii z rodzaju Bifidobacterium. Z kolei większy odsetek Staphylococcus aureus wiązał się ze zwiększonym ryzykiem wystąpienia otyłości w wieku późniejszym. Znaczenie mikrobioty sugerują również wyniki badań epidemiologicznych, które wskazują na związek (asocjację) powtarzanych terapii antybiotykami u małych dzieci z późniejszym ryzykiem wystąpienia otyłości. Brakuje jednak silnych dowodów naukowych w postaci wyników badań z randomizacją, aby jednoznacznie potwierdzić przyczynowo-skutkowy charakter tego związku.
Programowanie metaboliczne a praktyka kliniczna
Celem, a zarazem wyzwaniem na przyszłość, jest przełożenie dostępnych danych naukowych z obszaru DOHaD na konkretne zalecenia praktyki klinicznej i programy zdrowotne na poziomie populacyjnym. Mimo że aktualne działania organizacji rządowych oraz zrzeszających specjalistów związanych z opieką zdrowotną lub zdrowiem publicznym mające na celu zapobieganie chorobom cywilizacyjnym we wczesnym okresie życia ocenia się jako niewystarczające, coraz częściej wytyczne żywieniowe lub praktyki klinicznej uwzględniają wpływ zdrowia i żywienia w okresie przedkoncepcyjnym, prenatalnym czy niemowlęcym na długoterminowe zdrowotne punkty końcowe. Przykładem jest opublikowany w 2020 r. dokument określający stanowisko The International Federation of Gynecology and Obstetrics (FIGO), skupiający się na zdrowiu kobiet w okresie przedkoncepcyjnym. Głównym celem autorów było zwiększenie świadomości w kwestii znaczenia poradnictwa przedkoncepcyjnego wśród personelu medycznego systemu opieki zdrowotnej (m.in. lekarzy rodzinnych, ginekologów, położników i położnych czy pediatrów), którzy mają kontakt z kobietami w wieku prokreacyjnym. W dokumencie FIGO zawarto wytyczne praktyki klinicznej, zachęcając personel medyczny, aby przy okazji każdej konsultacji (niezależnie od jej przyczyny) udzielać kobietom porad i wsparcia w zakresie zdrowego żywienia oraz utrzymania prawidłowej masy ciała. Jednocześnie autorzy zwrócili uwagę na konieczność wyposażenia tej grupy profesjonalistów w odpowiednie narzędzia ułatwiające przeprowadzenie takiej porady i kluczową rolę organizacji zawodowych oraz zdrowia publicznego w zapewnieniu odpowiednich szkoleń personelu medycznego.
Podsumowanie
Liczne badania z zakresu nauk podstawowych oraz badania epidemiologiczne dostarczają coraz bardziej przekonujących dowodów naukowych na ogromny potencjał interwencji we wczesnym okresie życia, w tym żywieniowych, w zapobieganiu chorobom przewlekłym. W obliczu zwiększającej się zapadalności na wiele chorób cywilizacyjnych, obok poprawy jakości żywienia w czasie ciąży, promocji karmienia piersią i odpowiednich praktyk w zakresie wprowadzania pokarmów uzupełniających u niemowląt priorytetem staje się zwiększenie powszechnej świadomości na temat znaczenia stanu zdrowia kobiet i mężczyzn w okresie przedkoncepcyjnym. Personel medyczny systemu ochrony zdrowia odgrywa ważną rolę w działaniach mających na celu lepsze przygotowanie przyszłych rodziców do okresu ciąży, w tym także poprzez optymalizację ich diety.
Piśmiennictwo:
1. Arnesen E.K., Thorisdottir B., Lamberg-Allardt C. i wsp.: Protein intake in children and growth and risk of overweight or obesity: A systematic review and meta-analysis. Food Nutr. Res., 2022; 21: 662. Baird J., Fisher D., Lucas P. i wsp.: Being big or growing fast: systematic review of size and growth in infancy and later obesity. BMJ, 2005; 331: 929
3. Barker D.J.: The developmental origins of adult disease. Eur. J. Epidemiol., 2003; 18: 733–736 oraz J. Am. Coll. Nutr., 2004; 23: 588S–595S
4. Barker M., Dombrowski S.U., Colbourn T. i wsp.: Intervention strategies to improve nutrition and health behaviours before conception. Lancet, 2018; 391: 1853–1864
5. Cukrowska B.: Programowanie mikrobiotyczne – homeostaza mikrobioty jelitowej a ryzyko chorób cywilizacyjnych. Stand. Med. Pediatr., 2014; 11: 913–922
6. English L.K., Obbagy J.E., Wong Y.P. i wsp.: Types and amounts of complementary foods and beverages consumed and growth, size, and body composition: a systematic review. Am. J. Clin. Nutr., 2019; 109: 956S–977S
7. Fleming T.P., Watkins A.J., Velazquez M.A. i wsp.: Origins of lifetime health around the time of conception: causes and consequences. Lancet, 2018; 391: 1842–1852
8. Gaillard R., Wright J., Jaddoe V.W.V.: Lifestyle intervention strategies in early life to improve pregnancy outcomes and long-term health of offspring: a narrative review. J. Dev. Orig. Health Dis., 2019; 10: 314–321
9. Gruszfeld D., Weber M., Gradowska K. i wsp.: Association of early protein intake and pre peritoneal fat at five years of age: Follow up of a randomized clinical trial. Nutr. Metab. Cardiovasc. Dis., 2016; 26: 824–832
10. Horta B.L., de Mola C.L., Victora C.G.: Breastfeeding and intelligence: systematic review and meta analysis. Acta Paediatr., 2015; 104: 14–19
11. Horta B.L., de Mola C.L., Victora C.G.: Long term consequences of breastfeeding on cholesterol, obesity, systolic blood pressure and type 2 diabetes: a systematic review and meta analysis. Acta Paediatr., 2015; 104: 30–37
12. Horta B.L., Rollins N., Dias M.S. i wsp.: Systematic review and meta-analysis of breastfeeding and later overweight or obesity expands on previous study for World Health Organization. Acta Paediatr., 2022; 00: 1–8
13. Jacob C.M., Hanson M.: Implications of the Developmental Origins of Health and Disease concept for policy-making. Curr. Opin. Endocr. Metab. Res., 2020; 13: 20–27
14. Jacob C.M., Killeen S.L., McAuliffe F.M. i wsp.: Prevention of noncommunicable diseases by interventions in the preconception period: A FIGO position paper for action by healthcare practitioners. Int. J. Gynaecol. Obstet., 2020; 151: 6–15
15. Kalliomäki M., Collado M.C., Salminen S. i wsp.: Early differences in fecal microbiota composition in children may predict overweight. Am. J. Clin. Nutr., 2008; 87: 534–538
16. Lawlor D.A., Smith G.D., O’Callaghan M. i wsp.: Evidence for the fetal overnutrition hypothesis: findings from the mater university study of pregnancy and its outcomes. Am. J. Epidemiol., 2007; 165: 418–424
17. Marshall N.E., Abrams B., Barbour L.A. i wsp.: The importance of nutrition in pregnancy and lactation: lifelong consequences. Am. J. Obstet. Gynecol., 2022; 226: 607–632
18. Martin R.M., Kramer M.S., Patel R. i wsp.: Effects of promoting long-term, exclusive breastfeeding on adolescent adiposity, blood pressure, and growth trajectories: a secondary analysis of a randomized clinical trial. JAMA Pediatr., 2017; 171: e170 698
19. Meng X., Zhu Y., Di H. i wsp.: Dose-response association of early-life antibiotic exposure and subsequent overweight or obesity in children: A meta-analysis of prospective studies. Obes. Rev., 2021; 22: e13 321
20. Patro-Gołąb B., Zalewski B.M., Kołodziej M. i wsp.: Nutritional interventions or exposures in infants and children aged up to 3 years and their effects on subsequent risk of overweight, obesity and body fat: a systematic review of systematic reviews. Obes. Rev., 2016; 17: 1245–1257
21. Patro Gołąb B., Zalewski B.M., Kouwenhoven S.M. i wsp.: Protein concentration in milk formula, growth, and later risk of obesity: a systematic review. J. Nutr., 2016; 146: 551–564
22. Rolland Cachera M.F., Deheeger M., Akrout M. i wsp.: Influence of macronutrients on adiposity development: a follow up study of nutrition and growth from 10 months to 8 years of age. Int. J. Obes. Relat. Metab. Disord., 1995; 19: 573–578
23. Socha P., Grote V., Gruszfeld D. i wsp.: Milk protein intake, the metabolic endocrine response, and growth in infancy: data from a randomized clinical trial. Am. J. Clin. Nutr., 2011; 94: 1776S–1784S
24. Stephenson J., Heslehurst N., Hall J. i wsp.: Before the beginning: nutrition and lifestyle in the preconception period and its importance for future health. Lancet, 2018; 391: 1830–1841
25. Stoody E.E., Spahn J.M., Casavale K.O.: The Pregnancy and Birth to 24 Months Project: a series of systematic reviews on diet and health. Am. J. Clin. Nutr., 2019; 109: 685S–697S
26. Voerman E., Santos S., Patro-Golab B. i wsp.: Maternal body mass index, gestational weight gain, and the risk of overweight and obesity across childhood: An individual participant data meta-analysis. PLoS Med., 2019; 16: e1 002 744
27. Wall C.R., Hill R.J., Lovell A.L. i wsp.: A multicenter, double-blind, randomized, placebo-controlled trial to evaluate the effect of consuming Growing Up Milk “Lite” on body composition in children aged 12–23 mo. Am. J. Clin. Nutr., 2019; 109: 576–585
28. Wang Y., Wang K., Du M. i wsp.: Maternal consumption of ultra-processed foods and subsequent risk of offspring overweight or obesity: results from three prospective cohort studies. BMJ, 2022; 379: e071 767
29. Williams T.C., Drake A.J.: What a general paediatrician needs to know about early life programming. Arch. Dis. Child., 2015; 100: 1058–1063
30. Yang S., Martin R.M., Oken E. i wsp.: Breastfeeding during infancy and neurocognitive function in adolescence: 16-year follow-up of the PROBIT cluster-randomized trial. PLoS Med., 2018; 15: e1 002 554
31. Zalewski B., Patro-Gołąb B., Bożek B. i wsp.: Interventions to prevent DOHaD effects in infancy and early childhood. W: Developmental Origins of Health and Disease. Cambridge University Press, Cambridge 2022: 189–202














