Wstęp
Prawidłowo skomponowana, zbilansowana dieta zapewnia zdrowemu dziecku wystarczającą ilość pierwiastków śladowych i witamin do zachowania zdrowia oraz prawidłowego funkcjonowania. Jeśli przestrzega się zasad zdrowego żywienia, to nie ma konieczności rutynowej suplementacji, z wyjątkiem kilku wskazań omówionych poniżej.
Witamina D
Witamina D jest niezbędna w regulacji gospodarki wapniowo-fosforanowej i odgrywa kluczową rolę w procesie tworzenia tkanki kostnej. Jej niedobór jest przyczyną przede wszystkim hipokalcemii, hipofosfatemii, krzywicy i tężyczki.
Dwie główne postaci chemiczne witaminy D (kalcyferolu) to witamina D2 (ergokalcyferol) i witamina D3 (cholekalcyferol).
Epidemiologia i czynniki ryzyka
Niedobór witaminy D3 jest częsty u dzieci i młodzieży w Europie, zwłaszcza w grupach ryzyka. Do czynników ryzyka niedoboru należą:
- karmienie wyłącznie piersią,
- wcześniactwo (zwłaszcza urodzenie ≤32. tc. lub z masą ciała <1500 g),
- ciemny kolor skóry,
- niewystarczająca ekspozycja na słońce (nadmierne użycie filtrów przeciwsłonecznych, przebywanie w zamkniętych pomieszczeniach, odzież zakrywająca większość powierzchni skóry),
- otyłość – osoby otyłe zazwyczaj wymagają 2-krotnie większej dawki wit. D niż zalecana dla rówieśników o prawidłowej masie ciała,
- choroby przewlekłe (m.in. zaburzenia wchłaniania, długotrwałe diety eliminacyjne, zaburzenia odżywiania [np. jadłowstręt psychiczny], mukowiscydoza, przewlekłe zapalne choroby jelit, choroby wątroby [zwłaszcza przytarczyc lub tarczycy z niedoczynnością lub nadczynnością, upośledzenie umysłowe, padaczka, mózgowe porażenie dziecięce, autyzm, ciężkie nieskorygowane wrodzone wady serca, zapalne choroby tkanki łącznej, przewlekłe unieruchomienie),
- przewlekłe stosowanie niektórych leków (GKS [dawka prednizonu ≥7 mg/d], leków przeciwpadaczkowych, ketokonazolu, leków przeciwretrowirusowych),
- przebyty objawowy niedobór witaminy D3, który wymagał leczenia.
Zgodnie z zaleceniami zespołu polskich ekspertów (2023 r.) nie ma istotnych wskazań do rutynowego oznaczania stężenia witaminy D (25-OH-D) w surowicy w populacji ogólnej zdrowych dzieci. Zaleca się je natomiast w celu monitorowania niedoboru lub efektów jego leczenia w wymienionych powyżej grupach ryzyka, gdyż w niektórych przypadkach (np. otyłość, przewlekłe leczenie GKS, niektórymi lekami przeciwpadaczkowymi [walproinian, fenytoina], lekami przeciwgrzybiczymi podawnymi ogólnoustrojowo lub przeciretrowirusowymi) skuteczna dawka witaminy D może być 2–4-krotnie większa od zalecanej u zdrowych rówieśników, aby uzyskać zadowalające (>20 ng/ml) lub optymalne (30–50 ng/ml) stężenia 25-OH-D w surowicy.
Źródła witaminy D3 i suplementacja
Źródłem endogennej witaminy D3 jest synteza w skórze pod wpływem promieni słonecznych (UVB), a naturalnej egzogennej – niektóre pokarmy (głównie tłuste ryby, żółtko jaja, pełnotłuste produkty mleczne).
Ze względu na częste występowanie niedoboru dodatkowo w celu zapobiegania krzywicy i osteomalacji zaleca się suplementację witaminy D3 doustnie. Proponowane przez wybrane towarzystwa naukowe schematy suplementacji nieznacznie się różnią (tab. 1).
Tzw. plejotropowe efekty witaminy D pozostają natomiast nadal w sferze hipotez – nie udowodniono korzystnego wpływu dodatkowej suplementacji lub podawania większej niż zalecana dawki witaminy D osobom zdrowym na ryzyko zachorowania na infekcyjne zapalenia dróg oddechowych (w tym COVID-19), choroby alergiczne, depresję, nowotwory złośliwe lub choroby układu sercowo-naczyniowego.
| Tabela 1. Zalecenia towarzystw naukowych i grup ekspertów dotyczące suplementacji witaminy D (cholekalcyferolu)a u dzieci | ||||
|---|---|---|---|---|
| Wiek | ESPGHAN (2013 r.) | Global Consensus (ESPE; 2016 r.) | AAP (2014 r.) | Zalecenia polskie (2023 r.)b |
| niemowlęta | wszystkie: 400 IUc | wszystkie: 400 IUc | karmione piersią: 400 IUc karmione mlekiem modyfikowanym wzbogaconym w wit. D (<1 l/d): 400 IUc | wszystkie ≤6 mż.: 400 IUc,e
6.–12. mż.: 400–600 IUf |
| >12. mż. | tylko grupy ryzykad: 600 IU | optymalnie w diecie; ew. jako lek lub suplement: 600 IU | optymalnie w diecie; ew. jako lek lub suplement: 600 IU | zależnie od wieku
– 1–10 lat: 600–1000 IUg – 11–18 lat: 1000–2000 IUg |
| a dawka w IU/d (400 IU = 10 µg)
b Płudowski P. i wsp.; Nutrients, 2023; 15, 695 c od urodzenia d p. tekst e Wcześniaki urodzone ≤32. tc.: 800 IU/d (gdy możliwe żywienie enteralne) pod kontrolą stężenia 25-OH-D w surowicy (pierwsze oznaczenie >4 tyg. po rozpoczęciu suplementacji), także po wypisie ze szpitala (ryzyko przedawkowania, gdy łączna dawka wit. D [suplementy i pokarm] >1000 IU/d, zwłaszcza gdy urodzeniowa masa ciała <1000 g (spożycie z pokarmem wlicza się od 2. mż.); wcześniaki urodzone ≥33. tc.: 400 IU/d (nie zaleca się rutynowego oznaczania stężenia 25-OH-D). f zależnie od spożycia w pożywieniu g W wieku 1–3 lat: 600 IU/d przez cały rok. U zdrowych dzieci >3. rż. przebywających na słońcu z odkrytymi przedramionami i podudziami przez 15–30 min (4–10 lat) lub 30–45 min (11–18 lat)/d w godz. 10.00–15.00 bez kremów z filtrem UVB od maja do września suplementacja w tym okresie nie jest konieczna. W innym przypadku (grupy ryzyka niedoboru, niedostateczna ekspozycja na słońce), zaleca się wit. D przez cały rok zależnie od masy ciała i spożycia z pokarmami (w wieku >10 lat alternatywnie można zastosować kalcyfediol p.o. w dawce 10 µg/d pod kontrolą stężenia 25-OH-D w surowicy [pierwsze oznaczenie po 6–8 dniach]). AAP – American Academy of Pediatrics, d – doba, ESPE – European Society for Pediatric Endocrinology, ESPGHAN – European Society for Pediatric Gastroenterology, Hepatology, and Nutrition, IU – jednostka międzynarodowa, p.o. – doustnie | ||||
Witamina K
Witamina K jest niezbędna do prawidłowego procesu krzepnięcia. Odgrywa rolę w gammakarboksylacji zależnych od witaminy K czynników krzepnięcia – II (protrombiny), VII, IX, X oraz białka C i białka S. Działa jako katalizator karboksylacji reszt kwasu glutaminowego do reszt kwasu gammakarboksyglutaminowego. Jej niedobór jest przyczyną zaburzeń w układzie krzepnięcia, które objawiają się skazą krwotoczną osoczową (krwawienie z niedoboru wit. K – VKDB).
Taką samą potranslacyjną modyfikację przechodzi osteokalcyna, stąd ważna rola witaminy K również w mineralizacji kości.
Epidemiologia i czynniki ryzyka
Do grupy zagrożonej niedoborem witaminy K należą noworodki (transport witaminy K przez łożysko jest ograniczony) oraz niemowlęta w pierwszych miesiącach życia karmione piersią (mała ilość wit. K w mleku kobiecym ~20 IU/l; prawdopodobnie także inny skład mikrobioty jelitowej w tym okresie). Zapadalność na VKDB u noworodków i niemowląt, a także czynniki ryzyka (tab. 2) zależą od postaci choroby. Ryzyko wystąpienia:
- wczesnej postaci VKDB u noworodków z grupy zwiększonego ryzyka, których matki nie otrzymywały witaminy K, wynosi 6–12%;
- klasycznej postaci VKDB u noworodków, które nie otrzymały witaminy K po urodzeniu, wynosi 10–1500 przypadków na 100 000 urodzeń (tak szeroki zakres zapadalności zależy od sposobu karmienia i innych czynników ryzyka);
- postaci późnej VKDB u dzieci, które nie otrzymały po urodzeniu profilaktycznie witaminy K, wynosi w krajach rozwiniętych przeciętnie 8,8 (zakres: 5,8–17,8) na 100 000 urodzeń, ale ta postać charakteryzuje się zdecydowanie poważniejszym przebiegiem i powikłaniami (zgon, trwałe uszkodzenie OUN).
| Tabela 2. Grupy i czynniki ryzyka krwawienia z niedoboru witaminy K (VKDB) u noworodków i niemowląt | |
|---|---|
| Postać VKDB | Grupy i czynniki ryzyka |
| wczesna
(1. dż.) |
noworodki matek, które w ostatnim okresie ciąży przyjmowały leki przeciwpadaczkowe (karbamazepina, barbiturany, fenytoina), doustne antykoagulanty (antagoniści wit. K), tuberkulostatyki (ryfampicyna, izoniazyd) i niektóre antybiotyki (np. cefalosporyny)a |
| klasyczna
(2.–7. dż.) |
noworodki z porodów zabiegowych, urodzone przedwcześnie, w zamartwicy, z hipotrofią wewnątrzmaciczną i z zespołem aspiracji smółkib |
| późna
(>7. dż.) |
wątroby i dróg żółciowych prowadzące do cholestazy (m.in. niedobór α1-antytrypsyny, atrezja zewnątrzwątrobowych dróg żółciowych), przewlekłe choroby przewodu pokarmowego upośledzające wchłanianie (mukowiscydoza, zespół krótkiego jelita, przewlekła biegunka) oraz stosowanie niektórych leków niekorzystnie wpływających na metabolizm i funkcję witaminy K, takich jak antybiotyki (przewlekle stosowanie) lub pochodne kumaryny |
|
a Postępowanie profilaktyczne polega na odstawieniu tych leków u ciężarnej
(jeśli jest to możliwe) co najmniej tydzień przed porodem. Alternatywnie
kobiecie w ciąży można podać witaminę K1, jednak ze względu na barierę
łożyskową należy stosować dużą dawkę (20 mg/d). Witaminę K1 należy
także podać noworodkowi natychmiast po urodzeniu w dawce 1 mg i.m.
(w przypadku wcześniaków w odpowiednio mniejszej, zależnie od masy ciała).
b Te noworodki bezwzględnie wymagają podania 1 mg witaminy K1 i.m. (w przypadku wcześniaków w odpowiednio mniejszej dawce, zależnie od masy ciała) niezwłocznie po urodzeniu. d – doba, dż. – doba życia | |
Źródła witaminy K
Witamina K występuje w 2 naturalnych postaciach:
- K1 – fitomenadion (filochinon), zawarty mleku krowim (~60 IU/l), w zielonych warzywach liściastych, soi i oleju sojowym, owocach, nasionach,
- K2 – menachinon, wytwarzany przez saprofityczne bakterie zasiedlające jelito grube; wykazuje 60% aktywności witaminy K1.
Menadion (witamina K3) to z kolei związek syntetyczny z grupy witaminy K, uzyskiwany w drodze chemicznej syntezy. Ze względu na działania toksyczne po podaniu dużej dawki dożylnie noworodkom (hemoliza, hiperbilirubinemia) aktualnie nie jest stosowany.
Suplementacja – profilaktyka VKDB
W celu zapobiegania VKDB wszystkie noworodki wymagają podania witaminy K1 wkrótce po urodzeniu (w ciągu 6 h). Aktualne wytyczne ESPGAHN, AAP, jak również polskie zalecenia Konsultanta Krajowego w dziedzinie pediatrii oraz PTP i PTN są zgodne, że preferowanym sposobem profilaktyki jest podanie witaminy K1 i.m. w odpowiedniej dawce, bez konieczności dalszej suplementacji p.o. Noworodkom urodzonym w fizjologicznym terminie zaleca się dawkę 1 mg i.m., a urodzonym przedwcześnie – dawkę zależną od urodzeniowej masy ciała (tab. 3). Takie postępowanie jest nie tylko najskuteczniejsze w profilaktyce wczesnej i późnej postaci VKDB, ale także bezpieczne i eliminuje problem nieprzestrzegania zaleceń przez rodziców, związany z profilaktyką p.o.
Jeśli rodzice nie wyrażają zgody na podanie witaminy K i.m. lub u dziecka występują rzadkie przeciwwskazania do wstrzyknięć i.m. (np. hemofilia), autorzy zaleceń dopuścili dwa alternatywne schematy profilaktyki p.o.:
- 3 razy 2 mg witaminy K1 (wkrótce po urodzeniu + w 4.–6. dż. + w 4.–6. tż.),
- 2 mg witaminy K1 wkrótce po urodzeniu + 1 mg co tydzień do końca 3. mż.
W profilaktyce VKDB zaleca się stosowanie preparatów witaminy K1 zarejestrowanych jako leki, a nie suplementy diety. Jedyne dostępne w Polsce preparaty lekowe zarejestrowane dla noworodków i niemowląt to Kanavit, Konakion MM i Konakion Prima Infanzia (można je stosować p.o., i.m., i.v.).
| Tabela 3. Dawki witaminy K1 i.m. zalecane po urodzeniu noworodkom urodzonym przedwcześnie | ||
|---|---|---|
| Urodzeniowa mc. (g) | Zalecenia KK i PTPa
(mg) |
Zalecenia PTNa
(mg) |
| <1000 | 0,5b | 0,3 |
| 1001–1500 | 0,5 | 0,4 |
| 1501–2500 | 1,0 | 0,5 |
| a Różnice w podanych zaleceniach dotyczące wcześniaków o mc. ≤1500 g są
niewielkie. Dzieci te otrzymują dodatkowo (i wielokrotnie) witaminę K1 także
i.v. w roztworach do żywienia pozajelitowego i we wzmacniaczu pokarmu
lub specjalnym mleku dla wcześniaków. Można się natomiast zastanawiać,
czy dawka zaproponowana przez PTN dla wcześniaków >1500 g mc., a zwłaszcza >2000 g mc., nie jest zbyt mała, by zagwarantować maksymalną
skuteczność profilaktyki. Na przykład wcześniak o mc. 2300 g, w stabilnym
stanie, dość szybko zostanie wypisany do domu. Zalecając dawkę 1 mg
i.m. noworodkom >1500 g mc., KK i eksperci PTP chcieli prawdopodobnie
oszczędzić pediatrom i lekarzom rodzinnym takich wątpliwości i dylematów.
b W razie kłopotów z podaniem i.m. u dzieci <750 g mc. można rozważyć drogę i.v. i.m. – domięśniowo, i.v. – dożylnie, KK – Konsultant krajowy w dziedzinie pediatrii, mc. – masa ciała, PTN – Polskie Towarzystwo Neonatologiczne, PTP – Polskie Towarzystwo Pediatryczne | ||
Żelazo
Okres szybkiego wzrastania sprawia, że zapotrzebowanie na żelazo u dzieci jest stosunkowo duże. Niedobór żelaza prowadzi do niedokrwistości z niedoboru żelaza, która może się wiązać m.in. z gorszymi parametrami rozwoju psychoruchowego. W 2014 r. ESPGHAN opublikowało stanowisko dotyczące zapotrzebowania na żelazo u niemowląt i małych dzieci, które uwzględniono w aktualnych zaleceniach polskich (PTGHiŻD).
Do czynników ryzyka niedoboru żelaza u niemowląt należą:
- w okresie ciąży:
a) zmniejszone zasoby żelaza u matki (niski status socjoekonomiczny, niedokrwistość w okresie ciąży u matki),
b) zaburzenia transportu łożyskowego (nikotynizm u matki, cukrzyca ciężarnej, nadciśnienie tętnicze, otyłość ciężarnej),
c) ciąża bliźniacza,
d) zbyt szybkie odcięcie pępowiny, - w okresie niemowlęcym:
a) wcześniactwo (skrócony okres gromadzenia żelaza),
b) hipotrofia wewnątrzmaciczna (upośledzenie transportu łożyskowego),
c) mała masa urodzeniowa,
d) niemowlęta karmione wyłącznie piersią >17.–26. tyg. życia,
e) zaburzenia wchłaniania (wady przewodu pokarmowego, martwicze zapalenie jelit, operacje w obrębie przewodu pokarmowego),
f) alergia na pokarm (mikrostraty z przewodu pokarmowego, zbyt restrykcyjne diety).
Główne przyczyny i czynniki ryzyka niedoboru żelaza
- Zbyt mała ilość żelaza dostarczana do organizmu
1) mniejsze zapasy żelaza z okresu życia płodowego
a) wcześniaki, noworodki z ciąż mnogich, noworodki zbyt małe w stosunku do wieku płodowego
b) niedokrwistość u matki w czasie ciąży
c) choroby matki w czasie ciąży powodujące niewydolność łożyska, takie jak: cukrzyca lub inne choroby przewlekłe (w tym otyłość), stan przedrzucawkowy lub nikotynizm
d) utrata krwi w okresie okołoporodowym (krwotok lub krwawienie, częste pobieranie krwi do badań u noworodka, przeciek płodowo-matczyny [łożysko przodujące, przedwczesne odklejenie łożyska, cięcie cesarskie, amniopunkcja, kordocenteza, uraz brzucha ciężarnej] lub zespół przetoczenia między płodami)
2) niedostateczne spożycie żelaza
a) karmienie wyłącznie piersią po 6. mż.
b) wprowadzenie do diety dużej ilości mleka krowiego przed 12. mż. (jest ubogie w żelazo)
c) niedoborowa dieta (eliminacja pokarmów bogatych w żelazo, w tym np. niezbilansowana dieta wegetariańska, a zwłaszcza wegańska)
d) brak łaknienia (choroby przewlekłe)
e) celowe ograniczanie spożycia (zaburzenia odżywiania się, odchudzanie u nastolatek lub sportowców)
3) zaburzenia wchłaniania
a) biegunka nawracająca lub przewlekła
b) celiakia lub inne zespoły upośledzonego wchłaniania
c) wady anatomiczne jelit (zespół krótkiego jelita, niedokonany zwrot jelit, skręt jelita)
d) zakażenie Helicobacter pylori z zapaleniem błony śluzowej żołądka - Nadmierna utrata żelaza
1) utrata krwi
a) ostre lub przewlekłe krwawienie (w tym obfite nieregularne miesiączki, idiopatyczna hemosyderoza płucna, krwinkomocz lub krwiomocz, krwawienie z przewodu pokarmowego [m.in. refluksowe zapalenie przełyku, krwotoczne zapalenie jelita grubego lub błony śluzowej żołądka, nieswoiste zapalenia jelit, uchyłek Meckla, martwicze zapalenie jelita, polipy lub naczyniaki])
b) przetoczenia wymienne (przetaczana krew ma mniejszy hematokryt)
c) zarażenia pasożytnicze (np. tęgoryjec dwunastnicy) - Zwiększone zapotrzebowanie na żelazo
1) okres szybkiego wzrastania u wcześniaków
2) okres szybkiego wzrastania w okresie dojrzewania
3) wyczynowe uprawianie wytrzymałościowych dyscyplin sportowych
4) ciąża
Suplementacja
- Niemowlęta urodzone w fizjologicznym terminie, o prawidłowej urodzeniowej masie ciała
Zgodnie ze stanowiskiem ESPGHAN, u zdrowych niemowląt i małych dzieci o prawidłowej urodzeniowej masie w krajach o małej częstości występowania niedokrwistości z niedoboru żelaza (takich jak Polska). Dotyczy to również niemowląt karmionych wyłącznie piersią.
Dostępne dane inaczej zinterpretowała AAP, która zaleca podawanie preparatów żelaza w dawce 1 mg/kg mc./d u dzieci karmionych wyłącznie lub głównie (>50% karmień) piersią, od chwili ukończenia 4. mż. do uzyskania zalecanego spożycia żelaza w pokarmach.
Preparaty mleka początkowego dla niemowląt są aktualnie wzbogacane w żelazo (4–8 mg/l), dlatego karmione nimi dzieci w pierwszym półroczu życia zazwyczaj spożywają odpowiednią ilość tego pierwiastka (0,6–1,2 mg/kg mc./d). Mleko następne również zawiera żelazo, jednak nie określono optymalnego stężenia. - Niemowlęta o małej urodzeniowej masie ciała i urodzone przedwcześnie
Dodatkowe podawanie preparatu żelaza zaleca się:
1) niemowlętom o urodzeniowej masie ciała 2000–2500 g (dawka 1–2 mg/kg mc./d do 6. mż.) – takie postępowanie zapobiega niedokrwistości z niedoboru żelaza, a także późniejszym zaburzeniom zachowania;
2) dzieciom urodzonym przedwcześnie karmionym piersią (dawka 2 mg/kg mc./d od 1. mż. do momentu osiągnięcia zalecanego spożycia żelaza z pokarmów).
Pokarmy uzupełniające
Od ~6. mż. wszystkie niemowlęta powinny otrzymywać pokarmy uzupełniające bogate w żelazo, w tym mięso lub produkty wzbogacane w żelazo (np. kaszki zbożowe dla dzieci). Żelazo hemowe pochodzące z mięsa wchłania się lepiej niż zawarte na przykład w produktach zbożowych wzbogacanych w ten pierwiastek.
Fluor
Fluor odgrywa istotną rolę w utrzymaniu zdrowych zębów i w profilaktyce próchnicy – zmniejsza rozpuszczalność szkliwa, ogranicza produkcję kwasu przez bakterie i stymuluje remineralizację. Bez względu na drogę podawania, działa głównie miejscowo (po przyjęciu doustnie wydziela się w ślinie i dopiero wówczas wywiera swój efekt na szkliwo).
Według aktualnych wytycznych najistotniejszymi elementami profilaktyki choroby próchnicowej zębów są:
- znajomość czynników ryzyka i ich unikanie (tab. 4),
- kształtowanie i przestrzeganie właściwych nawyków żywieniowych (tzw. kariostatycznych; tab. 4),
- 2-krotne w ciągu dnia (rano i wieczorem po ostatnim posiłku, a bezpośrednio przed snem) szczotkowanie zębów pastą z fluorem (tab. 5) – podstawowa metoda profilaktyki zalecana od pojawienia się pierwszego zęba, bez względu na poziom ryzyka próchnicy. Do 6. rż. to jedyna metoda rutynowej fluorkowej profilaktyki domowej. U dzieci starszych (zwłaszcza gdy ryzyko choroby próchnicowej jest zwiększone) można stosować dodatkowo płyny do płukania jamy ustnej zawierające 225–900 ppm fluoru. Pasty zawierające 5000 ppm fluoru są zlecane przez stomatologa pacjentom >16. rż. z grupy dużego ryzyka próchnicy, w tym m.in.: (1) leczonym stałymi aparatami ortodontycznymi, (2) z niezadowalającym efektem dotychczasowych metod profilaktyki, (3) z wczesnymi zmianami próchnicowymi w obrębie korony i korzenia zębów pomimo codziennego, regularnego używania standardowych past fluorkowych, (4) w razie odsłonięcia zębiny po zabiegach stomatologicznych (np. tzw. skalingu), (5) z kserostomią.
Istotnym zadaniem pediatrów i lekarzy rodzinnych jest edukowanie rodziców w zakresie wszystkich 3 elementów profilaktyki choroby próchnicowej, w tym – czym się kierować, wybierając pastę do zębów (odpowiednie stężenie fluoru) i jaką jej ilość stosować zależnie od wieku (większość rodziców nakłada jej zbyt dużo).
Zgodnie z aktualnymi zaleceniami grupy polskich ekspertów z dziedziny stomatologii dziecięcej i pediatrii dodatkowa suplementacja fluoru doustnie (tabletki, krople) nie jest zalecana w pierwszych 3 latach życia. Można ją rozważyć u dzieci >3. rż. obarczonych dużym ryzykiem choroby próchnicowej, gdy stężenie fluoru w wodzie pitnej wynosi <0,3 mg/l (czyli w większości miejscowości w Polsce) i istnieją przeciwskazania do miejscowej aplikacji preparatów zawierających fluorki (np. u chorych na astmę oskrzelową) lub u dzieci z niepełnosprawnością intelektualną. Decyzję podejmuje stomatolog.
Przedstawione zalecenia polskie są podobne do wytycznych amerykańskiego (AAPD) i europejskiego (EAPD) towarzystwa stomatologii dziecięcej, a także Światowej Federacji Stomatologicznej (FDI).
| Tabela 4. Czynniki związane z małym i dużym ryzykiem próchnicy u małych dzieci | |
|---|---|
| Ryzyko | Czynnik prognostyczny |
| małe | codzienne szczotkowanie zębów pastą z fluorem
picie wody z odpowiednią zawartością fluoru (>0,6 mg/l) regularna opieka stomatologiczna miejscowe stosowanie preparatów fluoru w gabinecie stomatologicznym (lakier, pianka lub żel, płukanka) odpowiednia dieta i nawyki żywieniowea |
| duże | widoczna próchnica lub wypełnienia
płytka nazębna aktywna próchnica u matki/opiekuna dziecka niski status społeczno-ekonomiczny rodziców/opiekunów >3 napoje lub posiłki zawierające cukier w ciągu dnia butelka z napojem zawierającym cukier podawana przed zaśnięciem (lub w celu usypiania) dodatkowe choroby lub inne obciążenia zdrowotne |
| a m.in. dieta bogata w wapń (nabiał), ograniczenie cukrów prostych, podawanie ksylitolu (m.in. jako substytutu cukru), picie wody zamiast słodzonych napojów i soków owocowych, kawałki surowych owoców i warzyw zamiast poddanych obróbce, karmienie z kubka >6. mż., odstawienie karmienia butelką w 12.–18. mż., regularne pory posiłków i unikanie podjadania między nimi, płukanie ust wodą po każdym posiłku | |
| Tabela 5. Aktualne (2019 r.) zasady stosowania past do zębów z fluorem w profilaktyce choroby próchnicowej | |||
|---|---|---|---|
| Ryzyko | Wiek | Stężenie fluoru (ppm) i ilość pasty | Częstotliwość szczotkowania |
| małe, średnie lub duże | 6.–36. mż. | 1000, ziarno ryżua | 2 razy/d |
| >36. mż. do 6. rż. | 1000 (1450, gdy duże ryzyko), ziarno grochua,b | ||
| ≥6 lat | 1000 (6–10 lat) lub 1500 (>10 lat), od połowy do całej długości szczoteczkib | ||
| bardzo duże | >16. rż. | 5000, cała długość szczoteczkib | 2 razy/d |
| a U małych dzieci po szczotkowaniu nadmiar pasty zetrzeć mokrym gazikiem.
b Starsze dzieci po szczotkowaniu nadmiar pasty powinny wypluć, nie płukać jamy ustnej. Do 8. rż. zęby powinni szczotkować dziecku rodzice (w tym nakładać zalecaną ilość pasty), a u starszych dzieci zaleca się nadzór osoby dorosłej (jego brak zwiększa ryzyko używania zbyt dużej ilości pasty lub nieskutecznego usuwania płytki nazębnej). d – doba, ppm – części na milion | |||
Ksylitol
Ksylitol to 5-węglowy alkohol cukrowy (cukier drzewny lub brzozowy), który występuje naturalnie w niektórych owocach, warzywach i roślinach. Ekstrahowany jest z brzozy, buku, owsa, kukurydzy lub wytłoków trzciny cukrowej. Został zaaprobowany przez amerykański FDA i europejski Scientific Committee on Food (SCF) jako słodzący dodatek do żywności. Ma podobnie słodki smak jak sacharoza, ale ma mniej kalorii (odpowiednio: 2,4 kcal/g vs 4 kcal/g) i znacznie mniejszy indeks glikemiczny (8 vs 70).
Częściowo wchłania się w jelitach i jest następnie metabolizowany (głównie niezależnie od insuliny) albo wydalany z moczem. Niewchłonięta część ulega fermentacji w jelicie grubym i jest wydalana.
Ksylitol wykazuje działanie przeciwpróchnicowe (nie podlega metabolizmowi bakterii kariogennych), a także zmniejsza ryzyko zapalenia ucha środkowego.
Dodawany jest do wielu produktów żywnościowych (mleka, cukierków, żelków i innych słodyczy), jest również dostępny w postaci gumy do żucia, syropu, tabletek do ssania i środków do higieny stomatologicznej (np. płukanek, past do zębów, nitek dentystycznych, chusteczek do higieny jamy ustnej niemowląt).
Jest bezpieczny dla dzieci, jeśli nie przekracza się zalecanej dawki 8 mg/d. Zbyt duże spożycie (u dzieci ≥45 g/d, u dorosłych ≥100 g/d) może działać przeczyszczająco (biegunka osmotyczna).
Brak jest jednoznacznych zaleceń co do spożywania ksylitolu przez dzieci. Aktualne stanowisko AAPD wspiera stosowanie ksylitolu jako zamiennika cukru. Podkreśla jednak, że nie ma spójnych dowodów na istotne zmniejszenie ryzyka próchnicy u dzieci, a ponadto w praktyce trudno spożywać ksylitol w dawce (4–15 g/d) oraz z częstotliwością (3–7 razy/d), które według dostęnych danych naukowych mogą mieć potencjalnie korzystny wpływ na ryzyko próchnicy.
Niezbędne nienasycone kwasy tłuszczowe
W polskich zaleceniach dotyczących żywienia niemowląt podkreślono istotne znaczenie w diecie dziecka produktów bogatych w niezbędne nienasycone kwasy tłuszczowe (α-linolenowy i linolowy). Są one prekursorami LCPUFA (ryc.), w tym DHA i AA, które wchodzą w skład błon komórkowych (zwłaszcza komórek nerwowych i siatkówki). Pełnią one szczególnie istotną rolę w rozwoju płodu i dziecka. Podstawowym źródłem omega-3 LCPUFA (w tym DHA) w diecie – oprócz mleka kobiecego i mleka modyfikowanego z dodatkiem LCPUFA – są ryby.
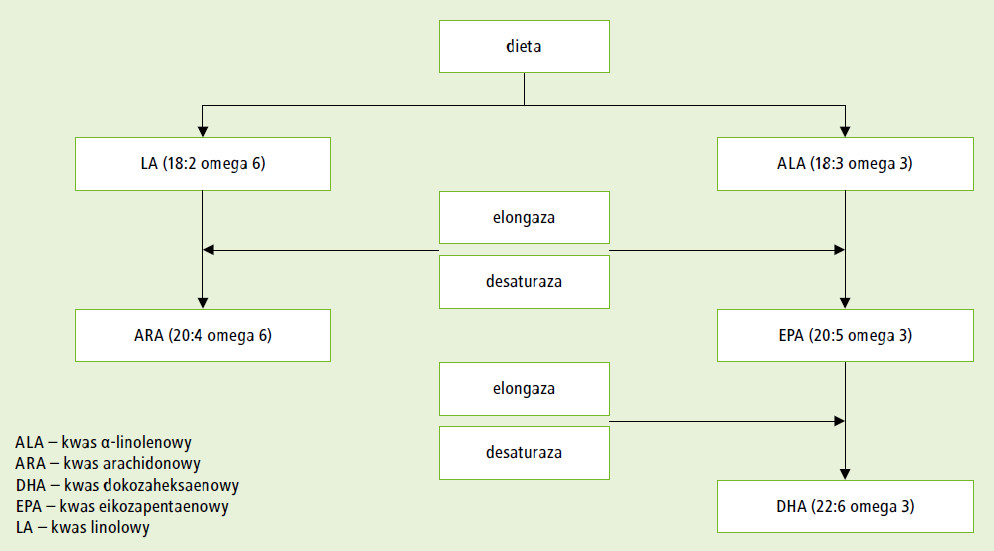
Ryc. Metabolizm wielonienasyconych kwasów tłuszczowych
Suplementacja
- Niemowlęta
Zgodnie z aktualnymi zaleceniami polskimi niemowlęta karmione piersią nie wymagają suplementacji DHA (dietę bogatą w kwasy omega-3 lub odpowiednią dawkę DHA w postaci suplementu zaleca się natomiast ich matkom).
U niemowląt karmionych mlekiem modyfikowanym w pierwszym półroczu życia DHA zawarte w mleku pokrywają zapotrzebowanie na ten kwas tłuszczowy. Wydaje się, że dodatek DHA do mleka modyfikowanego, który aktualnie jest obowiązkowy, może korzystnie wpływać na ostrość widzenia niemowląt, choć dostępne dane naukowe na ten temat nie są spójne. Dodatkowa suplementacja DHA u niemowląt karmionych mlekiem modyfikowanym >6. mż. może być korzystna, gdy łączne spożycie DHA wraz z pokarmami uzupełniającymi i mlekiem modyfikowanym jest niewystarczające (<100 mg/d).
Suplementacja DHA u noworodków urodzonych przedwcześnie. - Dzieci 1.–3. rż.
Dodatkową suplementację DHA należy rozważyć jedynie u dzieci, które nie przyjmują w diecie zalecanej dawki LCPUFA omega-3 (150–200 mg/d), np. nie spożywają regularnie ryb lub innych bogatych w te kwasy produktów. - Dzieci >3. rż.
Zalecenia polskie nie odnoszą się do dzieci starszych niż 3 lata. Jednak zgodnie ze stanowiskiem EFSA w grupie dzieci od 2. do 18. rż., podobnie jak w populacji ogólnej, zaleca się spożywanie 1–2 porcji tłustych ryb tygodniowo lub ~250 mg/d omega-3 LCPUFA.
Jod
Jod wchodzi w skład hormonów tarczycy, warunkuje więc ich prawidłową syntezę. Tym samym odgrywa istotną rolę w regulacji ważnych dla organizmu procesów biochemicznych, takich jak synteza białek i aktywność enzymatyczna.
Niedobór jodu należy do najczęstszych przyczyn zaburzeń rozwoju intelektualnego dzieci. Jest przyczyną powiększenia tarczycy (wole endemiczne). Łagodny niedobór w okresie prenatalnym może mieć także związek z gorszym rozwojem psychoruchowym dzieci.
Epidemiologia i czynniki ryzyka
Na początku lat. 90. XX w. umiarkowany niedobór jodu wykazano niemal w całej Polsce, a na Wybrzeżu niedobór łagodny. Systematycznie realizowany od 1996 r. krajowy program profilaktyki jodowej doprowadził do istotnej poprawy sytuacji epidemiologicznej. Aktualnie w Polsce względny niedobór jodu w stosunku do zapotrzebowania można stwierdzić praktycznie jedynie u kobiet w ciąży i karmiących piersią.
Do grupy ryzyka niedoboru jodu należą:
- kobiety ciężarne i karmiące piersią,
- noworodki,
- dzieci oraz młodzież w okresie dojrzewania.
Narodowy Program Eliminacji Niedoboru Jodu
Eliminacja niedoboru jodu od roku 1980 stała się jednym z głównych zadań WHO w zakresie ochrony zdrowia publicznego na świecie. Dzięki wdrożonym działaniom, we współpracy z takimi organizacjami, jak UNICEF i International Council for Control of Iodine Deficiency Disorders, w wielu krajach udało się wprowadzić programy jodowania soli spożywczej, których celem było dostarczenie odpowiedniej dawki jodu w diecie.
W Polsce profilaktyka jodowa (obowiązkowe jodowanie soli oraz dodatek jodu do mleka modyfikowanego dla niemowląt) i kontrola jej efektywności poprzez Narodowy Program Eliminacji Niedoboru Jodu pozwoliły na likwidację wola endemicznego u dzieci w wieku szkolnym, zmniejszenie częstości jego występowania w starszych grupach wiekowych (także u kobiet w ciąży), zahamowanie zapadalności na raka tarczycy u dorosłych i zmniejszenie częstości występowania przejściowej niedoczynności tarczycy u noworodków.
W ostatnich latach ze względu na zalecane przez WHO ograniczenie spożycia soli zwrócono jednak uwagę na konieczność wprowadzenia dodatkowych nośników jodu w produktach spożywczych, takich jak ryby morskie, mleko, jaja, warzywa i owoce oraz naturalne wody mineralne o znanym stężeniu jodków (100–200 µg/l).
Suplementacja
W Polsce dodatkową suplementację, oprócz jodu pochodzącego z diety, zaleca się kobietom w ciąży oraz karmiącym piersią (dawka 150–200 µg/d w postaci leku).
Piśmiennictwo:
1. Abrams S.A.: Dietary guidelines for calcium and vitamin D: a new era. Pediatrics, 2011; 127: 566–5682. Aglipay M., Birken C.S., Parkin P.C. i wsp.; TARGet Kids! Collaboration: Effect of high-dose vs standard-dose wintertime vitamin D supplementation on viral upper respiratory tract infections in young healthy children. JAMA, 2017; 318: 245–254
3. American Academy of Pediatrics Committee on Nutrition: Iron. W: Kleinman R.E., Greer F.E. (red.): Pediatric nutrition. American Academy of Pediatrics, Itasca (IL) 2019: 561–590
4. American Academy of Pediatrics Committee on Nutrition: Trace elements. W: Kleinman R.E., Greer F.E. (red.): Pediatric nutrition. American Academy of Pediatrics, Itasca (IL) 2019: 591–624
5. American Academy of Pediatrics Committee on Nutrition: Vitamins. W: Kleinman R.E., Greer F.E. (red.): Pediatric nutrition. American Academy of Pediatrics, Itasca (IL) 2019: 625–677
6. American Academy of Pediatric Dentistry: Caries-risk assessment and management of infants, children and adolescents. The Reference Manual of Pediatric Dentistry. American Academy of Pediatric Dentistry, Chicago, Ill., 2022: 266–272
7. American Academy of Pediatric Dentistry: Policy on use of xylitol in pediatric dentistry. The Reference Manual of Pediatric Dentistry. American Academy of Pediatric Dentistry, Chicago, Ill., 2022: 76–77
8. Baker R.D., Greer F.R. and The Committee On Nutrition American Academy of Pediatrics: Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0–3 years of age). Pediatrics, 2010; 126: 1040–1050
9. Braegger C., Campoy C., Colomb V. i wsp.: ESPGHAN Committee on Nutrition. Vitamin D in the healthy European paediatric population. J. Pediatr. Gastroenterol. Nutr., 2013; 56: 692–701
10. Commission Delegated Regulation (EU) 2016/127 of 25 September 2015 supplementing Regulation (EU) No 609/2013 of the European Parliament and of the Council as regards the specific compositional and information requirements for infant formula and follow-on formula and as regards requirements on information relating to infant and young child feeding. Official Journal of the European Union, L 25, 2 February 2016. www.eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A32016R0127
11. Domellöf M., Braegger C., Campoy C. i wsp.: ESPGHAN Committee on Nutrition. Iron requirements of infants and toddlers. J. Pediatr. Gastroenterol. Nutr., 2014; 58: 119–129
12. Dziechciarz P.: Plejotropowe działanie witaminy D – o odsiewaniu ziaren od plew. Med. Prakt. Pediatr., 2016; 4: 11–15
13. EFSA Panel on Dietetic Products, Nutrition, and Allergies (NDA): Scientific Opinion on Dietary Reference Values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. www.efsa.europa.eu/en/efsajournal/pub/1461
14. Golden N.H., Abrams S.A.; AAP Committee on Nutrition: Optimizing bone health in children and adolescents. Pediatrics, 2014; 134: e1229–1243
15. Jackowska T., Peregud-Pogorzelski J.: Profilaktyka krwawienia z niedoboru witaminy K. Zalecenia Konsultanta Krajowego w dziedzinie pediatrii i Polskiego Towarzystwa Pediatrycznego. Ped. Pol., 2016; 91: 602–605
16. Jasani J.B., Simmer K., Patole S.K. iwsp.: Long chain polyunsaturated fatty acid supplementation in infants born at term (Review). Cochrane Database Syst. Rev., 2017; 3: CD000376
17. Kaczmarek U., Jackowska T., Mielnik-Błaszczak M. i wsp.: Indywidualna profilaktyka fluorkowa u dzieci i młodzieży – rekomendacje polskich ekspertów. Nowa Stomatol., 2019; 24: 70–85
18. Mihatsch W., Braegger C., Bronsky J. i wsp.: ESPGHAN Committee on Nutrition. Prevention of Vitamin K deficiency bleeding in newborn infants: a position paper by the ESPGHAN Committee on Nutrition. J. Pediatr. Gastroenterol. Nutr., 2016; 63: 123–129
19. Munns C.F., Shaw N., Kiely M. i wsp.: Global consensus recommendations on prevention and management of nutritional rickets. J. Clin. Endocrinol. Metabol., 2016; 101: 394–415
20. Płudowski P., Kos-Kudła B., Walczak M. i wsp.: Guidelines for preventing and treating vitamin D deficiency: A 2023 update in Poland. Nutrients, 2023; 15: 695
21. Sankar M.J., Chandrasekaran A., Kumar P. i wsp.: Vitamin K prophylaxis for prevention of vitamin K deficiency bleeding: a systematic review. J. Perinatol., 2016; 36 (Suppl. 1): S29–S35
22. Szajewska H., Socha P., Horvath A. i wsp.: Zasady żywienia zdrowych niemowląt. Stanowisko Polskiego Towarzystwa Gastroenterologii, Hepatologii i Żywienia Dzieci. Stand. Med. Pediatr., 2021; 18: 805–822
23. Taylor P., Vaidya B., Taylor P. i wsp.: Iodine supplementation in pregnancy – is it time? Clin. Endocrinol. (Oxf), 2016; 85: 10–14
24. Toumba K.J., Twetman S.,· Splieth C. i wsp.: Guidelines on the use of fluoride for caries prevention in children: an updated EAPD policy document. Europ. Archiv. Paediatr. Dent., 2019; 20: 507–516
25. WHO. Micronutrint deficiency. Iodine deficiency disorders. www.who.int/nutrition/topics/idd/en/
26. Zarząd Główny Polskiego Towarzystwa Neonatologicznego: Zapobieganie krwawieniu z niedoboru witaminy K u noworodków. Med. Prakt. Pediatr., 2016; 4: 154
27. Zimmer M., Sieroszewski P., Oszukowski P. i wsp.: Rekomendacje Polskiego Towarzystwa Ginekologów i Położników dotyczące suplementacji u kobiet ciężarnych. Ginekol. Perinatol. Prakt., 2020; 4: 170–181















